Transpunere Beckmann
Transpunerea lui Beckmann , care își ia numele de la chimistul german Ernst Otto Beckmann (1853-1923), este o reacție de rearanjare , în cataliză acidă, a unei oxime pentru a da o amidă . [1] [2] [3] Amidele ciclice se numesc lactame .
Acest exemplu de reacție [4] , care pornește de la ciclohexanonă , trece prin formarea oximei ciclohexanonei ca intermediar de reacție și duce la formarea caprolactamei , este una dintre cele mai importante aplicații ale transpunerii lui Beckmann, deoarece caprolactama este o materie primă material pentru producerea de nailon .
O sinteză industrială a paracetamolului dezvoltată de Hoechst - Celanese implică conversia unei cetone în ketoximă prin hidroxilamină.
Soluția Beckmann este compusă din acid acetic , acid clorhidric și anhidridă acetică și a fost utilizată pe scară largă pentru cataliza reacției. Se pot utiliza și alți acizi, cum ar fi acidul sulfuric sau acidul fosforic . Acidul sulfuric este cel mai frecvent utilizat pentru producția industrială de lactame datorită producției de sulfat de amoniu ca produs secundar atunci când este tratat cu amoniac . Sulfatul de amoniu este un îngrășământ agricol comun ca sursă de compuși de azot și sulf.
Mecanismul reacției
Se crede că mecanismul de reacție al transpunerii lui Beckmann constă într-o migrație alchil cu expulzarea unei grupări hidroxil și formarea unui ion nitriliu urmată de hidroliză :
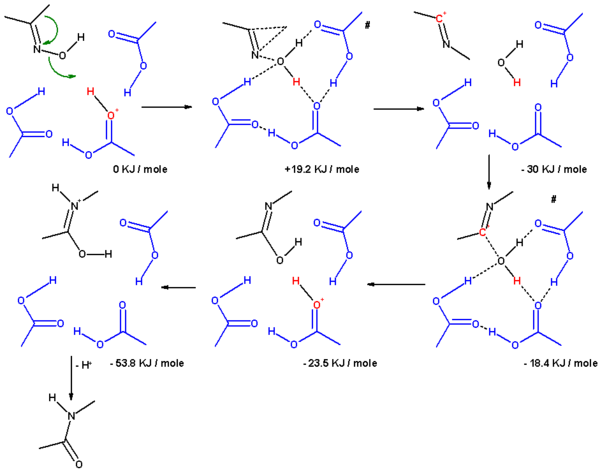
Într-un studiu, [5] mecanismul este stabilit în silico luând în considerare prezența substituenților și a moleculelor de solvent . Rearanjarea acetonei oximei în soluția Beckmann implică trei molecule de acid acetic și un proton (prezent sub forma unui ion oxoniu). În starea de tranziție care duce la ionul iminium (complexul σ), gruparea metil migrează către atomul de azot cu un mecanism concertat și gruparea hidroxil este expulzată. Atomul de oxigen al grupării hidroxil este stabilizat de trei molecule de acid acetic. În etapa următoare, carbonul electrofil al ionului nitril este atacat de apă și protonul este redat acidului acetic. În starea de tranziție care duce la acidul N-metil acetamidă, oxigenul din apă este coordonat cu 4 atomi. În a treia etapă, un mecanism de izomerizare protejează atomul de azot în amidă .
Același procedeu cu ionul de hidroniu și 6 molecule de apă are același rezultat, dar, atunci când substituentul migrator este gruparea fenil în reacția dintre acetofenona oximă cu acid acetic protonat, mecanismul favorizează formarea unui complex -π intermediar al trei membri. Acest complex π nu a fost încă găsit în H 3 O + (H 2 O) 6 .
Cu oxima ciclohexanonei, tensiunea inelului conduce la un al treilea mecanism de reacție, care duce direct la caprolactamă protonată într-o singură etapă concertată fără formarea intermediară a complexelor σ sau π.
Catalizatori
Reacția Beckmann este cunoscută pentru posibilitatea de a fi catalizată de clorura cianurică , în co-cataliză a clorurii de zinc. De exemplu, ciclododecanona poate fi convertită în lactamul corespunzător, un monomer pentru producția de Nylon-12 . [6] [7]
Mecanismul acestei reacții se bazează pe un ciclu de cataliză cu clorură de cianuric, care activează gruparea hidroxil printr-o substituție nucleofilă aromatică . Produsul de reacție este deplasat și depozitat de noul reactiv prin complexul intermediar Meisenheimer.
Fragmentarea Beckmann
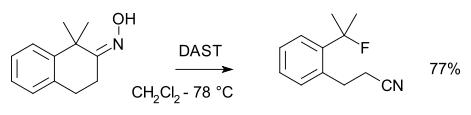
Când oxima poartă un carbon cuaternar într-o poziție antiplană în raport cu gruparea hidroxil, apare o fragmentare care formează un nitril :
Donatorul de fluor din această reacție este sulfura de trifluor dietilenamină: [8]
Reacția Semmler - Wolff
Oxima cicloesenonei cu acizi formează anilină într-o reacție de deshidrogenare - numită reacție de aromatizare sau Wolff-Semmler Aromatization Wolff [9] [10] [11] [12]
Notă
- ^ E. Beckmann , Zur Kenntniss der Isonitrosoverbindungen , în Berichte der Deutschen Chemischen Gesellschaft , vol. 19, 1886, pp. 988-993, DOI : 10.1002 / cber.188601901222 .
- ^ LG Donaruma și Heldt, WZ, rearanjarea Beckmann. (Recenzie) , în Org. Reacţiona. , vol. 11, 1960, pp. 1-156.
- ^ RE Gawley, Reacțiile Beckmann: rearanjare, eliminare-adăugiri, fragmentări și rearanjamente-ciclizări. (Recenzie) , în Org. Reacţiona. , vol. 35, 1988, pp. 14-24.
- ^ JC Eck și Marvel, CS, Acid Benz-benzoylaminocaproic , în sinteze organice, Coll. , vol. 19, 1939, p. 20, DOI : 10.15227 / orgsyn.019.0020 . Adus la 8 februarie 2016 (arhivat din original la 30 septembrie 2007) . JC Eck și Marvel, CS, acid Ε-benzoilamino-caproic , în sinteze organice, col. , vol. 2, 1943, p. 76. Adus la 8 februarie 2016 (arhivat din original la 30 septembrie 2007) .
- ^ S. Yamabe, Tsuchida, N. și Yamazaki, S., Este rearanjarea Beckmann o reacție concertată sau pas cu pas? A Computational Study , în Journal of Organic Chemistry , vol. 70, nr. 26, 2005, pp. 10638-10644, DOI : 10.1021 / jo0508346 , PMID 16355980 .
- ^ Y. Furuya, Ishihara, K. și Yamamoto, H., Cianuric Chloride as a Mild and Active Beckmann Rearrangement Catalyst , în J. Am. Chem. Soc. , Vol. 127, nr. 32, 2005, pp. 11240-11241, DOI : 10.1021 / ja053441x , PMID 16089442 .
- ^ Douglass F. Taber și Patrick J. Straney, The Synthesis of Laurolactam from Cyclododecanone via a Beckmann Rearrangement , în J. Chem. Educ. , vol. 87, nr. 12, 2010, p. 1392, DOI : 10.1021 / ed100599q .
- ^ Masayuki Kirihara, Niimi, Kanako and Momose, Takefumi, Fluorinative-cleavage of cetoximes cyclic with dietylaminosulfur trifluoride: a eficient synthesis of fluorinated carbonitriles , in Chemical Communications , vol. 6, nr. 6, 1997, pp. 599-600, DOI : 10.1039 / a607749h .
- ^ W. Semmler, Ber. 25, 3352 (1892)
- ^ L. Wolff, Amp. 322, 351 (1902)
- ^ Denumiți reacțiile și reactivii în sinteza organică , Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro
- ^ Reamenajări Beckmann. O investigație a cazurilor speciale CE Horning, VL Stromberg, HA Lloyd J. Am. Chem. Soc. , 1952 , 74 (20), pp 5153-5155 DOI : 10.1021 / ja01140a048
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre Transpunerea lui Beckmann
Wikimedia Commons conține imagini sau alte fișiere despre Transpunerea lui Beckmann