Cicditionarea 1,3-dipolara
O cicloadiție 1,3-dipolară este o reacție chimică între un 1,3 dipol și un compus numit dipolarofil pentru a forma un inel cu cinci membri. Descris pentru prima dată în 1889 de Buchner , [1] mecanismul acestor cicloadiții a fost elucidat doar în anii 1960, în principal datorită lucrării lui Rolf Huisgen [2], motiv pentru care sunt adesea denumite cicloadiții Huisgen (când o azidă și un alchin ).
Cicloadițiile 1,3-dipolare prezintă regioselectivitate și stereoselectivitate remarcabile și se încadrează în categoria reacțiilor periciclice (sunt cicloadiții [4 + 2]). Se obțin heterocicluri cu 5 membri, aromatice dacă se utilizează un alchin ca dipolarofil.
Prezentare generală a mecanismului
Inițial natura acestor cicloadiții a fost dezbătută mult timp. Cea mai acceptată ipoteză a implicat un mecanism periciclic, propus de Huisgen [3], dar au existat și susținători ai unui proces în mai multe etape care implică un intermediar de radicalizare (așa cum sugerează Firestone). [4] După un deceniu de discuții și datorită progreselor tehnologice, în 1976 a fost posibil să se confirme natura periciclică a reacțiilor. [5]
Dipolul 1,3 reacționează cu dipolarofilul cu un mecanism concertat, adesea asincron, reprezentând o cicloadiție [ π 4 s + π 2 s ], trecând printr-o stare de tranziție ciclică aromatică conform lui Hückel . Există, totuși, două excepții, reprezentate de reacțiile ilide ale tiocarbonili [6] și oxizi de nitrili . [7]
Mecanism periciclic
Huisgen a investigat o serie de cicloadiții între compuși azotati 1,3-dipolari și diferiți alcheni dipolarofili. [3] Următoarele observații susțin mecanismul periciclic și resping ipotezele unui curs etapizat.
- Efectul substituenților . Diferenți înlocuitori pe dipol nu modifică în mod semnificativ viteza de cicditionare, sugerând că procesul nu trece printr-un intermediar cu sarcini separate.
- Efectul solvenților . Polaritatea solventului nu afectează viteza de reacție, în conformitate cu ceea ce se așteaptă din reacțiile periciclice.
- Stereochimie . Reacțiile 1,3-dipolare sunt întotdeauna stereospecifice în ceea ce privește dipolarofilul (de exemplu, o cis alchenă va da întotdeauna un produs de adaos la păcat ), în conformitate cu principiul reacțiilor periciclice care formează simultan două noi legături sigma.
- Termodinamica . Aceste reacții au o entropie de activare neobișnuită foarte negativă, similară cu cea găsită pentru reacția Diels-Alder , de asemenea periciclică și cicloadiție.
Dipol 1.3
Un compus dipolar 1,3 este o moleculă organică care poate fi reprezentată atât ca o structură alilică, cât și ca o propargil-alenil zwitterion. [8] Există și dipoli care conțin sulf sau fosfor, dar sunt rareori folosiți.
Este posibil să trasăm mai multe structuri de rezonanță care să delocalizeze sarcinile pozitive și negative pe orice atom, dar în general pentru o reprezentare corectă ne bazăm pe calcule experimentale sau de calcul. [9] [10] Un exemplu de 1,3-dipol clasic este diazometanul , așa cum se arată în figura de mai jos.
Datorită ambivalenței sale, capetele unui compus 1,3-dipolar pot acționa atât ca nucleofil, cât și ca electrofil. Comportamentul mai mult sau mai puțin de un tip poate fi evaluat folosind teoria orbitalilor moleculari de frontieră, prin urmare cu calcule de calcul.
În general, se poate spune că atomul care prezintă cel mai mare coeficient orbital în HOMO va fi nucleofilul , în timp ce în LUMO va fi electrofilul. Adesea, dar nu neapărat, cel mai bogat atom electronic se comportă ca un nucleofil. [11] [12] [13]
Dipolarofil
Cele mai frecvente dipolarofile sunt alchenele și alchinele. Dipolarofilii care conțin un heteroatom, ca în cazul carbonililor și iminelor, pot suferi cicloadiție 1,3-dipolară. Alte exemple de dipolarofili includ fullereni și nanotuburi în așa-numita reacție Prato .
Efectul solvenților
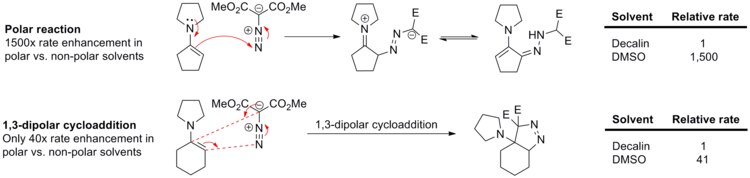
După cum sa menționat deja, aceste reacții suferă un efect redus sau deloc din partea solventului , deoarece atât reactanții, cât și stările de tranziție nu sunt polare. Mai jos este un exemplu de modul în care este afectată constanta cinetică în cazul reacției dintre fenil-diazometan și acrilat de etil sau norbornen , trecând de la ciclohexan la metanol . [14]
Absența oricărei influențe din partea solventului este demonstrată prin observarea incontestabil reacția enaminele cu dimetil diazomalonate. [15] Reacția polară din diagrama de mai jos este accelerată de 1500 de ori, în timp ce cicloadiția 1,3-dipolară este accelerată de doar 40 de ori, astfel încât efectul este mult mai puțin pronunțat.
Teoria orbitală moleculară de frontieră
Reacțiile 1,3-dipolare sunt reacții pericilice care respectă regulile Dewar-Zimmerman și regulile echivalente Woodward-Hofmann . În exemplul de mai sus, în prima interpretare, reacția se desfășoară printr-o stare de tranziție aromatică conform lui Huckel. În a doua interpretare, orbitalii limită ai dipolului și dipolarofilului se suprapun într-un mod permis de regulile de simetrie.
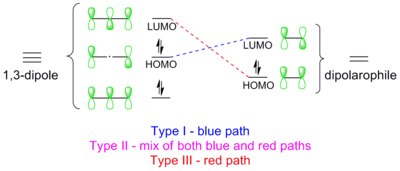
Deoarece există mai multe moduri în care reacția poate evolua, este obișnuit să se facă o distincție în trei tipuri diferite de cicloadiție 1,3-dipolară, pe baza modului în care se suprapun orbitalele. [16] Tipologia predominantă prevede o interacțiune HOMO-LUMO cu cel mai mic decalaj energetic posibil.
Tipul I.
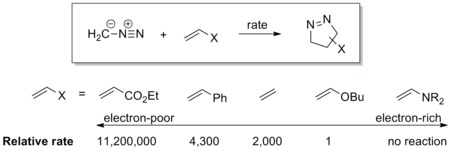
Dipolul are un HOMO energetic care se suprapune peste LUMO al dipolarofilului. Un dipol de acest tip se numește dipol controlat de HOMO sau dipol nucleofil . Exemplele includ ilide azotate și compuși diazo . Acești dipoli se adaugă rapid la alchenele electrofile. Grupurile de retragere de electroni (EWG) de pe dipolarofil pot accelera reacția prin scăderea energiei LUMO, în timp ce grupurile donatoare de electroni (EDG) o încetinesc, deoarece cresc energia HOMO.
De exemplu, scala de reactivitate a diazometanului, spre o serie de dipolarofili, este prezentată mai jos. Diazometanul reacționează cu acrilatul de etil sărac în electroni de peste un milion de ori mai repede decât face cu butil vinil eterul bogat în electroni. [17]
Acest tip de cicloadiție seamănă cu reacția Diels-Alder la cererea electronică normală , în care HOMO al dienei se combină cu LUMO al dienofilului.
Tipul II
HOMO-ul dipolului se cuplează cu LUMO-ul dipolarofilului. Alternativ, HOMO-ul dipolarofilului se cuplează cu LUMO-ul dipolului. Această interacțiune bidirecțională apare din faptul că saltul energetic dintre cei doi orbitali de frontieră (într-un sens sau altul) este foarte asemănător (și ușor de depășit). Un dipol din această categorie se numește dipol controlat HOMO-LUMO sau dipol amfifilic . Exemple sunt imidele nitrilice, nitronii, oxizii nitrilici și azidele.
Orice substituent de pe dipolarofil poate accelera reacția prin reducerea decalajului dintre cei doi orbitali care interacționează. Un EWG ar reduce energia LUMO, în timp ce un EDG ar crește cea a HOMO. Cu titlu de exemplu, este raportată scara de reactivitate a azidelor în raport cu diferiți compuși dipolarofili săraci în electroni. [18]
Tipul III
Dipolul are un LUMO cu energie redusă care se suprapune peste HOMO dipolarofil (prezentat cu linii întrerupte roșii în diagramă la începutul secțiunii). Un astfel de dipol este cunoscut sub numele de dipol controlat de LUMO sau dipol electrofil , cum ar fi oxidul de azot și ozonul . EWG-urile de pe dipolarofil accelerează reacția, în timp ce EDG-urile o accelerează. De exemplu, ozonul reacționează cu 2-metilpropenă (electrică) de aproximativ o sută de mii de ori mai repede decât cu tetracloretenă săracă în electroni. [19]
Acest tip de reacție amintește de reacția Diels-Alder cu cerere inversă de electroni , în care LUMO al dienei se combină cu HOMO al dienofilului.
Reactivitate
Procesele concertate, cum ar fi cicloadițiile 1,3-dipolare, necesită o stare de tranziție foarte ordonată (entropie de activare foarte negativă și entalpii moderate). Unii factori care afectează reactivitatea sunt enumerați mai josː
- Conjugarea ː în special cu grupările aromatice, are ca rezultat o creștere a vitezei de reacție datorită stabilizării suplimentare prin rezonanță. În timpul tranziției, două legături sigma se formează la viteze diferite, generând sarcini parțiale în starea de tranziție care, cu toate acestea, pot fi stabilizate datorită substituenților.
- Obstacolul steric în starea de tranziție scade viteza de reacție și chiar îl poate împiedica.
- Cei mai polarizați dipolarofili sunt mai reactivi, deoarece norul de electroni este mai predispus să se deplaseze între două molecule.
- Izomeria a dipolarofili afectează rata de reacție din motive sterice. De fapt, izomerii trans sunt mai reactivi deoarece sunt mai puțin voluminoși și mai puțin tensionați la nivelul unghiurilor de legătură. De exemplu, trans-stilbenul adaugă la difenil nitril imidă de 27 de ori mai rapid decât cis-stilbenul.
Stereospecificitate
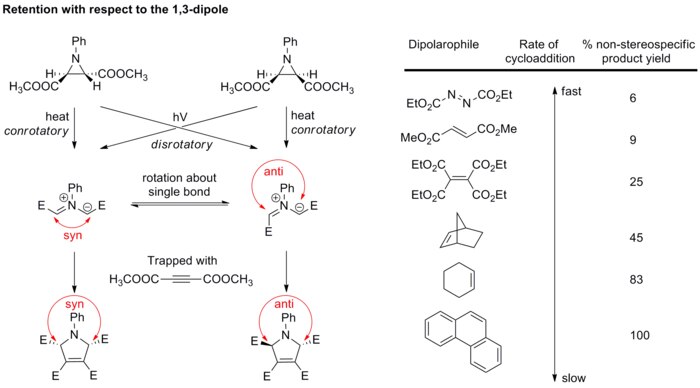
Cicloedițiile 1,3-dipolare implică, de obicei, retenția configurației în ceea ce privește atât dipolul, cât și dipolarofilul. Această stereospecificitate ridicată susține mecanismul periciclic.
Stereospecificitate față de dipolarofil
Substituenții cis pe dipolarophilic alchena ar conduce la un produs cis, în timp ce substituenții trans rămân trans în ciclul de 5 atomi obținut din reacția. [20]
Stereospecificitate în raport cu dipolul
În general, stereochimia dipolului nu este luată în considerare deoarece doar câțiva dipoli sunt capabili să formeze centre stereogene . Cu toate acestea, există o influență din partea substituenților și în acest caz. Un exemplu este prezentat în figura de mai jos. [21] [22]
Regioselectivitate
Pentru perechile asimetrice dipol-dipolarofil, se pot obține doi regioizomeri. Atât factorii sterici, cât și cei electronici trebuie invocați pentru a explica cursul reacțiilor. [23]
Efecte electronice
Interacțiunea electronică dominantă este combinația dintre cel mai mare HOMO și cel mai mare LUMO. Prin urmare, regioselectivitatea este guvernată de acei atomi care poartă cei mai mari coeficienți HOMO și LUMO. [24] [25]
Luați în considerare ciclodiția diazometanului la trei dipolarofiliːmetil acrilat, stiren și metil cinamat. Carbonul diazometanului este cel mai mare HOMO, în timp ce capătul olefinic al acrilatului de metil și al stirenului are cel mai mare LUMO. Astfel, cicloadiția conduce la substituție în poziția 3, regioselectiv. Pentru cinamatul de metil, cei doi substituenți (gruparea fenil și ester) concurează pentru a atrage electronii alchenei către ei înșiși. Carboxilul este un EWG mai bun decât fenilul și acest lucru face ca carbonul în poziția beta să fie mai electrofil. Prin urmare cicloadiția va duce la substituirea carboxilului în poziția 3 și a fenilului în poziția 4.
Efect steric
Efectele sterice pot favoriza sau dezavantaja efectele electronice menționate anterior. Uneori chiar duc la celălalt regioizomer. [3]
De exemplu, diazometanul se adaugă în general la acrilatul de metil pentru a da 3-carboxil pirazolină. În orice caz, prin creșterea cererii sterice a sistemului, ne dăm seama că se formează izomerul 4-carboxil pirazolină. Relația dintre cei doi regioizomeri depinde de cererea sterică. [26]
Aplicații sintetice
Ozon
Reacția de ozonoliză este un exemplu de cicloadiție 1,3-dipolară, în anumite limite. Cu acest mecanism, aldehide , cetone sau acizi carboxilici sunt obținute din alchene sau alchine.
Notă
- ^ Mattia Giacomello, cicloadiție 1,3-dipolară a unui diazoalcan coordonat cu alchene și alchine , pe dspace.unive.it . Adus la 3 septembrie 2020 .
- ^ Rolf Huisgen, 1.3-Dipolar Cycloadditionen Ruckschau und Ausblick. , în Angewandte Chemie , vol. 75, nr. 13, 1963, pp. 604-637, DOI : 10.1002 / ange.19630751304 .
- ^ a b c Rolf Huisgen, Kinetics and Mechanism of 1,3-Dipolar Cycloadditions , în Angewandte Chemie International Edition , vol. 2, nr. 11, noiembrie 1963, pp. 633-645, DOI : 10.1002 / an . 196306331 .
- ^ R Firestone, Mechanism of 1,3-dipolar cycloadditions , în Journal of Organic Chemistry , voi. 33, nr. 6, 1968, pp. 2285–2290, DOI : 10.1021 / jo01270a023 .
- ^ Rolf Huisgen, cicloadiții 1,3-dipolare. 76. Natura concertată a cicloadițiilor 1,3-dipolare și problema intermediarilor diradici , în Journal of Organic Chemistry , vol. 41, nr. 3, 1976, pp. 403–419, DOI : 10.1021 / jo00865a001 .
- ^ G. Mloston, E. Langhals și Rolf Huisgen, Cycloadditons 1,2-Dipolar în doi pași: Non-stereospecificitate , în J. Am. Chem. Soc. , Vol. 108, nr. 20, 1986, pp. 6401–66402, DOI : 10.1021 / ja00280a053 .
- ^ Siadati Seyyed Amir, Un exemplu de mecanism treptat pentru cicloadiția 1,3-dipolară fără catalizator între un oxid de nitril și o alchenă bogată în electroni , în Tetrahedron Letters , vol. 56, nr. 34, 2015, pp. 4857–4863, DOI : 10.1016 / j.tetlet.2015.06.048 .
- ^ Rolf Huisgen, Cycloadditions 1,3-Dipolar. Past and Future , în Angewandte Chemie International Edition , vol. 2, nr. 10, 1963, pp. 565–598, DOI : 10.1002 / an . 196305651 .
- ^ A Cox, L Thomas și J Sheridan, Spectrele cu microunde ale diazometanului și derivatele sale deutero , în Nature , vol. 181, nr. 4614, 1958, pp. 1000-1001, bibcode : 1958Natur.181.1000C , DOI : 10.1038 / 1811000a0 .
- ^ P Hilberty și C Leforestier, Extinderea funcțiilor undei orbitale moleculare în funcții de undă de legătură de valență. O procedură simplificată. , în Journal of the American Chemical Society , vol. 100, nr. 7, 1978, pp. 2012–2017, DOI : 10.1021 / ja00475a007 .
- ^ JF McGarrity și Saul Patai, Basicitate, aciditate și legături de hidrogen , în grupurile Diazonium și Diazo , vol. 1, 1978, pp. 179-230, DOI : 10.1002 / 9780470771549.ch6 , ISBN 978-0-470-77154-9 .
- ^ Daniel Berner și John McGarrity, Observarea directă a ionului metildiazoniu în acid fluorosulfuric , în Journal of the American Chemical Society , vol. 101, nr. 11, 1979, pp. 3135-3136, DOI : 10.1021 / ja00505a059 .
- ^ Eugen Muller și Wolfgans Rundel, Untersuchungen an Diazomethanen, VI. Mitteil.: Umsetzung von Diazoäthan mit Methyllithium , în Chemische Berichte , vol. 89, nr. 4, 1956, pp. 1065-1071, DOI : 10.1002 / cber . 19560890436 .
- ^ Jochen Geittner, Rolph Huisgen și Hans-Ulrich Reissig, Dependența solventului de ratele de cicloadiție a fenildiazometanului și parametrii de activare , în Heterocicli , vol. 11, 1978, pp. 109-120, DOI : 10.3987 / S (N) -1978-01-0109 .
- ^ Rolph Huisgen, Hans-Ulrich Reissig, Helmut Huber și Sabine Voss, compuși α-Diazocarbonyl și enamine - o dihotomie a căilor de reacție , în Tetrahedron Letters , vol. 20, nr. 32, 1979, pp. 2987-2990, DOI : 10.1016 / S0040-4039 (00) 70991-9 .
- ^ R Sustmann, Controlul energiei orbitale a reactivității cicloadiției , în chimia pură și aplicată , vol. 40, nr. 4, 1974, pp. 569–593, DOI : 10.1351 / pac197440040569 .
- ^ Jochen Geittner și Rolf Huisgen, Cinetica reacțiilor 1,3-dipolare de cicloadiție a diazometanului; O corelație cu energiile homo-lumo , în Tetrahedron Letters , vol. 18, nr. 10, 1977, pp. 881–884, DOI : 10.1016 / S0040-4039 (01) 92781-9 .
- ^ Rolf Huisgen, Gunter Szeimies și Leander Mobius, K1.3-Dipolar Cycloadditionen, XXXII. Kinetik der Additionen organischer Azide an CC-Mehrfachbindungen , în Chemische Berichte , vol. 100, nr. 8, 1967, pp. 2494-2507, DOI : 10.1002 / cber . 19671000806 .
- ^ DG Williamson și RJ Cvetanovic, Rate de reacții ozon-olefine în soluții de tetraclorură de carbon , în Journal of the American Chemical Society , vol. 90, n. 14, 1968, pp. 3668–3672, DOI : 10.1021 / ja01016a011 .
- ^ Werner Bihlmaier, Jochen Geittner, Rolf Huisgen și Hans-Ulrich Reissig P, The Stereospecificity of Diazomethane Cycloadditions , în Heterocycles , vol. 10, 1978, pp. 147–152, DOI : 10.3987 / S-1978-01-0147 .
- ^ Rolf Huisgen, Wolfgang Scheer și Helmut Huber, Stereospecific Conversion of cis-trans isomeric Aziridines to Open-Chain Azomethine Ylides , în Journal of the American Chemical Society , vol. 89, nr. 7, 1967, pp. 1753–1755, DOI : 10.1021 / ja00983a052 .
- ^ Alexander Dahmen, Helmut Hamberger, Rolf Huisgen și Volker Markowski, Deschiderea inelului rotativ de oxizi de cianostilben la iluri de carbonil , în Journal of the Chemical Society D: Chemical Communications , vol. 0, nr. 19, 1971, pp. 1192–1194, DOI : 10.1039 / C29710001192 .
- ^ Vsevolod V. Rostovtsev, Luke G. Green, Valery V. Fokin și K. Barry Sharpless, <2596 :: AID-ANIE2596> 3.0.CO; 2-4 A Huisgen Cicloadiția proces în trepte: cupru (I) catalizată regioselectivă Ligation of Azides and Terminal Alkynes , în Angewandte Chemie International Edition , vol. 41, nr. 14, 2002, pp. 2596-22599, DOI : 10.1002 / 1521-3773 (20020715) 41:14 <2596 :: AID-ANIE2596> 3.0.CO; 2-4 , PMID 12203546 .
- ^ Pierluigi Caramella și KN Houk, Geometries of nitrilium betaines. Clarificarea reacțiilor aparent anormale ale 1,3-dipolilor , în Journal of the American Chemical Society , vol. 98, nr. 20, 1976, pp. 6397–6399, DOI : 10.1021 / ja00436a062 .
- ^ Pierluigi Caramella, Ruth W. Gandour, Janet A. Hall, Cynthia G. Deville și KN Houk, O derivare a formelor și energiilor orbitalilor moleculari ai 1,3-dipolilor. Optimizări geometrice ale acestor specii de către MINDO / 2 și MINDO / 3 , în Journal of the American Chemical Society , vol. 99, nr. 2, 1977, pp. 385–392, DOI : 10.1021 / ja00444a013 .
- ^ Albert Padwa, 1,3-Dipolar Cycloaddition Chemistry , General Heterocyclic Chemistry Series, vol. 1, Statele Unite ale Americii, Wiley-Interscience, 1983, pp. 141-145, ISBN 978-0-471-08364-1 .
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe cicloadiție 1,3-dipolară
Wikimedia Commons conține imagini sau alte fișiere pe cicloadiție 1,3-dipolară