Triosmiu dodecacarbonil
| Triosmiu dodecacarbonil | |
|---|---|
| Numele IUPAC | |
| triosmiu dodecacarbonil | |
| Denumiri alternative | |
| dodecacarbonyltriosmium | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 12 O 12 Hos 3 |
| Aspect | solid |
| numar CAS | |
| Numărul EINECS | 239-789-3 |
| PubChem | 519165 |
| Proprietăți fizico-chimice | |
| Solubilitate în apă | insolubil |
| Temperatură de topire | 224 ° C (497 K) [1] |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
 | |
| Fraze H | 302 - 315 - 319 - 335 [2] |
| Sfaturi P | 261 - 305 + 351 + 338 [2] |
Triosmium dodecacarbonyl este clusterului compus chimic cu formula Os 3 (CO) 12. Este unul dintre carbonilii binari stabili ai osmiului . În condiții normale, este un solid galben, insolubil în apă, dar ușor solubil în solvenți organici. Disponibil comercial, este utilizat ca precursor pentru sinteza altor compuși organometalici de osmiu. [1] [3]
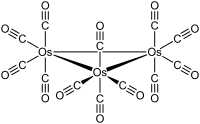
Structura
Os 3 (CO) 12 cristalizează cu o structură cristalină monoclinică, grup spațial P2 1 / c , cu constante de rețea a = 810 pm , b = 1 479 pm , c = 1 464 pm și β = 100 °, patru unități de formulă pe unitate de celulă . În structură există unități moleculare cu simetrie D 3h , formate dintr-un triunghi aproape echilateral de atomi de osmiu; distanța medie Os-Os este 288 pm . Fiecare atom de osmiu este legat de patru liganzi CO, doi în poziția axială și doi în poziția ecuatorială. [4] Structura este similară cu cea a Ru 3 (CO) 12 , în timp ce în Fe 3 (CO) 12 doi CO sunt conectați și simetria devine C 2v .
Sinteză
Clusterul a fost sintetizat pentru prima dată în 1943 de Walter Hieber prin reacția tetroxidului de osmiu cu monoxid de carbon sub presiune, dar dându-i în mod eronat formula Os 2 (CO) 9 . [5] În 1961 Eugene R. Corey și Lawrence F. Dahl au subliniat că formula corectă a fost Os 3 (CO) 12 . [6] Cu un control precis al condițiilor randamentul este aproape cantitativ: [7]
Reactivitate
Os 3 (CO) 12 este unul dintre carbonilii binari stabili ai osmiului; De asemenea, sunt cunoscuți Os 2 (CO) 9 , Os 4 (CO) 15 , Os 5 (CO) 16 , Os 6 (CO) 18 , Os 7 (CO) 21 , Os 8 (CO) 23 și Os 12 (CO) 30 . [1] [8]
Os 3 (CO) 12 este un cluster saturat, ceea ce înseamnă că fiecare atom de osmiu îndeplinește regula celor 18 electroni și, prin urmare, compusul este relativ nereactiv. [3] Prin încălzire peste 120 ° C sau prin activare fotochimică unul sau mai mulți liganzi CO pot fi înlocuiți cu baze Lewis L formând specii tip Os 3 (CO) 11 L , Os 3 (CO) 10 L 2 și Os 3 (CO) 9 L 3 . Liganzii tipici L sunt fosfine , fosfiți , oxizi de fosfină ( OPR 3 ), amine, acetonitril (MeCN). Acetonitrilul în special este un ligand foarte labil și, prin urmare, compușii Os 3 (CO) 11 (MeCN) și Os 3 (CO) 10 (MeCN) 2 sunt utilizați ca precursori pentru alte grupuri de osmiu. [9]
Liganzii CO pot fi înlocuiți și cu hidrogen, alchene și alchine ; acești noi liganzi tind să se lege în punți , ca de exemplu în Os 3 (μ-H) 2 (CO) 10 și Os 3 (μ-PhC≡CPh) 2 (CO) 10 . [3]
Piroliza Os 3 (CO) 12 permite obținerea de clustere cu o nuclearitate mai mare. În acest proces pot fi adăugați alți atomi, cum ar fi hidrogenul și calcogenii . Două exemple sunt Os 4 (CO) 12 H 2 și Os 4 (CO) 12 (μ3-S) . [3]
Notă
Bibliografie
- ( EN ) ER Corey și LF Dahl, osmiu trinuclear și ruteniu carbonili și identitățile lor cu Os 2 (CO) 9 și Ru 2 (CO) 9 raportate anterior , în J. Am. Chem. Soc. , Vol. 83, nr. 9, 1961, pp. 2203-2204, DOI : 10.1021 / ja01470a044 .
- ( EN ) ER Corey și LF Dahl, Structura moleculară și cristalină a Os 3 (CO) 12 , în Inorg. Chem. , vol. 1, nr. 3, 1962, pp. 521-526, DOI : 10.1021 / ic50003a016 .
- ( EN ) SR Drake și PA Loveday, Dodecarbonyltriosmium , în Inorg. Sintetizator. , vol. 28, 1990, pp. 230–231, DOI : 10.1002 / 9780470132593.ch57 .
- ( DE ) W. Hieber și H. Stallman, Über Osmiumcarbonyle , în Z. Elektrochem. , vol. 49, 1943, pp. 288-292.
- ( DE ) AF Holleman și N. Wiberg, Lehrbuch der Anorganischen Chemie , Berlin, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1 .
- ( EN ) JN Nicholls și MD Vargas, Unele derivate utile ale Dodecarbonyltriosmium , în Inorg. Sintetizator. , vol. 28, 1990, pp. 232-235, DOI : 10.1002 / 9780470132593.ch58 .
- ( EN ) PR Raithby și AL Johnson, Clustere Trinucleare de Ru / Os fără Liganzi de Hidrocarburi , în DMP Mingos și RH Crabtree (eds), Comprehensive Organometallic Chemistry III , 6: Compounds of Group 8, Elsevier, 2007, ISBN 978-0- 08-045047-6 .
- ( EN ) PA Shapley, Osmium: Organometallic Chemistry , în Encyclopedia of Inorganic Chemistry , ediția a doua, John Wiley & Sons, 2006, DOI : 10.1002 / 0470862106.ia172 , ISBN 9780470862100 .
- Sigma-Aldrich, fișa cu date de securitate Triruthenium dodecacarbonyl , la sigmaaldrich.com , 2019. Accesat la 16 martie 2020 .
- ( EN ) JS-Y. Wong, Z.-Y. Lin și W.-T. Wong, sinteză și caracterizarea structurală a unui nou cluster Dodecaosmium Carbonyl [ Os 12 (CO) 30 ] Derivat dintr-un nou Cluster μ4-Oxo Hexaosmium Carbonyl [ Os 6 (CO) 16 (μ4-O) (μ-OH) 2 (μ -CO) 2 ] , în Organometallics , vol. 22, n. 23, 2003, pp. 4798-4802, DOI : 10.1021 / om030271t .