Legătură covalentă
În chimie , o legătură covalentă este o legătură chimică în care doi atomi împărtășesc perechi de electroni .
Acest lucru se întâmplă deoarece atomii tind la cea mai mică cheltuială de energie posibilă obținută cu stabilitatea configurației lor electronice (de exemplu octetul ). Orbitalele atomice care conțin electronii nepereche se suprapun în orbitalele moleculare , rezultând o moleculă .
Tipul legăturilor covalente
Legătură covalentă pură
Legătura covalentă este rezultatul unei interacțiuni electrostatice care implică atomii. Această interacțiune electrostatică are loc între nucleele atomilor (încărcați pozitiv) și electronii împărțiți ( încărcați negativ).
Electronii împărțiți prin legătura covalentă sunt delocalizați în jurul celor doi atomi, formând un așa-numit „nor electronic”, adică un spațiu în care există posibilitatea de a găsi electronii partajați. Vorbim despre o legătură covalentă pură dacă apare între atomi egali. Dacă apare între atomi cu o diferență de electronegativitate între zero și 0,4, se numește covalent homopolar sau apolar . Norul de electroni este distribuit simetric (adică legătura este nepolarizată). În acest caz, dubletul de electroni este împărțit în mod egal între cei doi atomi implicați, adică electronii împărtășiți petrec același timp în apropierea fiecăruia dintre cei doi atomi, neavând o preferință specială pentru unul dintre cei doi atomi.
O legătură covalentă homopolară apare atunci când diferența de electronegativitate între doi atomi este mai mică sau egală cu 0,4.
Un exemplu de moleculă care conține o legătură covalentă pură este molecula de hidrogen , obținut prin combinarea a doi atomi de hidrogen:
H· + ·H → H:H
În general, legătura covalentă pură apare atunci când atomii implicați în legătură aparțin aceluiași element chimic . În acest caz, de fapt, diferența de electronegativitate între cei doi atomi este zero.
Legătura covalentă polară
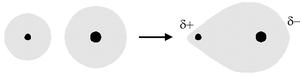
În cazul în care există o diferență moderată de electronegativitate între cei doi atomi implicați în legătura covalentă (pentru care există un dipol molecular permanent), electronii partajați sunt mai atrași de atomul mai electronegativ, legătura va fi, prin urmare, polarizată electric .
În acest caz vorbim de o legătură covalentă heteropolară (sau polară ).
O legătură covalentă polară se stabilește atunci când orbitalii atomici ai doi atomi se suprapun cu o diferență de electronegativitate mai mică sau egală cu 1,7 [1] și mai mare decât 0,4.
De exemplu, diferența de electronegativitate între hidrogen (2,10) și clor (3,16) este egală cu 1,06 (= 3,16 - 2,10), deci legătura dintre hidrogen și clor din molecula de acid clorhidric este de tip covalent heteropolar.
Coordonare sau legătură dativă
Când ambii electroni implicați în legătură provin doar dintr-unul dintre cei doi atomi, în timp ce celălalt oferă un orbital gol în care să îi aloce, se numește legătură de coordonare .
Legătura covalentă și legătura ionică
Când dubletele de electroni sunt puternic legate de cel mai electronegativ element, nu mai vorbim de o legătură covalentă, ci de o legătură ionică ; prin convenție, vorbim de o legătură ionică dacă diferența de electronegativitate între atomii implicați în legătură este mai mare de 1,7, în timp ce vorbim de o legătură covalentă atunci când diferența de electronegativitate între atomii implicați în legătură este mai mică sau egală la 1, 7.
Valența legăturilor covalente
În funcție de numărul de electroni împărțiți, pot apărea următoarele cazuri:
- legătură covalentă simplă (sau legătură monovalentă sau legătură simplă): se împarte o singură pereche de electroni; în formulele chimice această legătură este reprezentată cu o singură liniuță ( ) poziționat între cei doi atomi implicați în legătură (de exemplu: );
- legătură covalentă dublă (sau legătură divalentă): se împart două perechi de electroni; în formulele chimice această legătură este reprezentată cu o liniuță dublă ( ) poziționat între cei doi atomi implicați în legătură (de exemplu: );
- legătură covalentă triplă (sau legătură trivalentă): se împart trei perechi de electroni; în formulele chimice această legătură este reprezentată cu o liniuță triplă ( ) poziționat între cei doi atomi implicați în legătură (de exemplu: ).
Există, de asemenea, legături tetravalente (studiate pe larg în chimia anorganică ) și în 2005 s-a arătat existența legăturilor cvintuple în molecule stabile. [2]
Legături covalente polare și polaritatea moleculelor
Moleculele care conțin legături covalente polare pot avea o anumită polaritate cauzată de o distribuție nesimetrică a sarcinilor.
De exemplu, molecula de apă are două legături covalente polare între oxigen și fiecare dintre cei doi atomi de hidrogen . Electronegativitatea oxigenului (aproximativ 3,52) prevalează asupra celei de hidrogen (aproximativ 2,11), atrăgând electronii celor doi atomi de hidrogen spre acesta și polarizând fiecare legătură. Molecula de apă are un unghi de legătură de 104 ° 45 'și, în ansamblu, constituie un dipol electric care are capătul negativ în atomul de oxigen și capătul pozitiv în cei doi atomi de hidrogen.
Mai simplu este cazul moleculei de acid clorhidric : în acest caz, electronegativitatea mai mare a clorului determină molecula să fie un dipol care are capătul negativ în atomul de clor și capătul pozitiv în atomul de hidrogen.
În alte cazuri, o distribuție simetrică a sarcinilor poate fi asociată cu legăturile covalente polare, astfel încât molecula este apolară.
De exemplu, atomii moleculei de dioxid de carbon sunt dispuși de-a lungul unei linii drepte . În timp ce fiecare este dublă polar, simetria moleculei anulează cele două polarități egale în intensitate, dar opuse în direcție. Prin urmare, molecula de dioxid de carbon este ca un întreg apolar.
Notă
- ^ Depaoli, Chimie generală și anorganică , p.84
- ^ Sinteza unui compus stabil cu o legătură de cinci ori între două centre de crom (I) Tailuan Nguyen, Andrew D. Sutton, Marcin Brynda, James C. Fettinger, Gary J. Long și Philip P. Power Publicat online 22 septembrie 2005 ; 10.1126 / Science.1116789 Informații despre asistență Arhivat 1 octombrie 2007 la Internet Archive .
Bibliografie
- TW Graham Solomons, Organic Chemistry , ediția a II-a, Bologna, Zanichelli, 2001, pp. 6-7, ISBN 88-08-09414-6 .
- Alberto Costanzo, Exerciții de chimie. Compendiu teoretic și exerciții de chimie pentru inginerie , ediția a II-a, Esculapio, 2010, ISBN 978-88-7488-377-6 .
Elemente conexe
- Legătură chimică
- Σ legătură
- Π legătură
- Δ legătură
- Legătură de coordonare
- Legătură ionică
- Polaritatea moleculelor
- Rezonanță (chimie)
linkuri externe
- ( RO ) IUPAC Gold Book, „legătură covalentă” , pe goldbook.iupac.org .