Substitui

În chimia organică și biochimie, termenul substituent sau grup substituent se referă la o structură moleculară (un singur atom sau un grup de atomi) care este considerată „substituită” pentru unul sau mai mulți atomi de hidrogen din cadrul unei molecule organice [1] [2 ] ] . Termenul nu se referă la substituirea hidrogenului legat de atomii de calcogen [3] . Nomenclatura IUPAC prevede utilizarea sufixului _il pentru a indica substituentul al cărui nume este precedat și de un număr care îi identifică poziția în cadrul moleculei. Conceptul de substituent nu trebuie confundat cu cel de substituție . Deși cele două pot fi legate, un grup substituent definit nu este întotdeauna rezultatul unei reacții de substituție, termenul substituent este limitat la descrierea unui aspect pur structural al unei molecule. Foarte des un substituent este, de asemenea, o grupare funcțională .
Nomenclatură
Aplicați în mod normal regula sufixului _il , regula apoziției numărului care indică poziția substituentului în moleculă și regula prefixului în eventualitatea în care apar mai mulți substituenți identici; de exemplu, în cazul unei molecule de piperidină substituită în poziția 2 cu doi radicali ( di_ ) de etenă, va exista un derivat cu numele IUPAC 2,2-dietenilpiperidină . Cu toate acestea, există grupuri substituente foarte frecvente (aproape întotdeauna grupuri funcționale) și, în general, de dimensiuni mici, care respectă reguli de nomenclatură diferite:
| -OH | hidroxi_ |
| = O | os_ |
| -SAU | _oase_ |
| -SH | tio_ |
| -NU 2 | nitro_ |
| -NH 2 | amino_ |
În cazul în care substituenții sunt halogeni, grupul păstrează numele atomului fără sufix, ca în cazul clorobenzenului sau al 2-bromopropanului . Evident, o singură structură de bază poate fi înlocuită cu diferite grupuri substituente:
Molecula din exemplu are trei substituenți diferiți (marcați în albastru) legați de structura de bază a octanului . Denumirea IUPAC a structurii este 6-brom-3-etil-4-metoxioctan .
Proprietățile fizico-chimice ale substituenților
Grupurile substituente pot modifica radical proprietățile fizico-chimice ale moleculei substituite. Aceste modificări sunt exprimate numeric printr-o serie de constante legate de diferitele proprietăți chimice, fizice și cinetice ale moleculelor substituite și nesubstituite.
Constanta lui Hammett
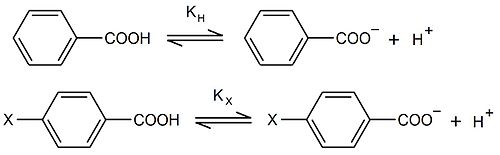
Constanta Hammet (σ) sau sigma Hammet este un parametru chimic care cuantifică influența pe care o are introducerea unui substituent X asupra reactivității unei molecule în raport cu structura de bază în raport cu efectul inductiv și efectul de rezonanță exercitat de substituent. Σ nu este o valoare tipică a unui grup substituent și trebuie măsurată întotdeauna luând în considerare proprietățile moleculei substituite; valorile tabelate ale σ prin convenție sunt de fapt legate de efectul pe care un substituent în poziția para (uneori chiar în meta ) asupra acidului benzoic îl exercită asupra constantei de disociere a acidului slab:
K H și K X sunt constanta de disociere a acidului benzoic nesubstituit și constanta de disociere a acidului substituit, respectiv, din care se obține constanta Hammet:
În cazul în care K X > K H și, prin urmare, σ X > 0, substituentul X se va comporta ca un atractiv de electroni, în timp ce în cazul în care K X <K H și, prin urmare, σ X <0, substituentul X se va comporta prin donator de electroni. În sfârșit, este important să ne amintim că, prin definiție, σ de hidrogen (σ H ) este întotdeauna egal cu zero .
Constantă de hidrofobitate
Constanta de hidrofobicitate (π) este un parametru chimic care cuantifică influența pe care o are introducerea unui substituent X asupra lipofilicității unei molecule în raport cu structura de bază. Ecuația este exprimată ca:
Unde logP X și logP H reprezintă respectiv coeficienții de partiție ai moleculei substituite și ale moleculei nesubstituite. În cazul în care logP X > logP H și, prin urmare, π X > 0, substituentul X va crește lipofilicitatea moleculei, în timp ce în cazul în care logP X <logP H și, prin urmare, π X <0, substituentul X va scădea lipofilicitatea moleculei. În mod similar cu ceea ce se întâmplă pentru constanta lui Hammett, π de hidrogen (π H ) este întotdeauna, prin definiție, egal cu zero. Conform acestui sens, logP-ul unei molecule este definit ca suma logP-ului atomilor individuali care alcătuiesc acea moleculă, prin urmare, constanta de hidrofobicitate este un concept cumulativ:
În exemplu, vrem să calculăm logP-ul 3-clorobenzamidei având ca date experimentale logP (benzen) , logP (clorobenzen) și logP (benzamidă) :
logP (benzen) = 2,13 logP (clorobenzen) = 2,84 logP (benzamidă) = 0,64
Prin urmare, vom obține:
logP ( Cl ) = logP (clorobenzen) - logP (benzen) = 2,84 - 2,13 = 0,71 logP ( CONH 2 ) = logP (benzamidă) - logP (benzen) = 0,69 - 2,13 = - 1,49
din care vom calcula:
logP (3-clorobenzamidă) = logP (benzen) + logP (Cl) + logP (CONH 2 ) = 2,13 + 0,71 - 1,49 = 1,35
Conform definiției, logP (benzen) și logP (CONH 2 ) reprezintă suma logP a atomilor individuali din care sunt compuși. Cu toate acestea, este foarte important să ne amintim că constanta de hidrofobicitate astfel calculată nu ia în considerare unii parametri fizico-chimici care influențează semnificativ lipofilicitatea unei molecule precum momentul dipolar și posibila formare a legăturilor intra sau intermoleculare . logP experimental va fi deci întotdeauna mai mult sau mai puțin diferit de valoarea teoretică logP, care rămâne totuși o bază importantă pentru determinarea și prezicerea logP probabilă a unei molecule substituite.
În exemplu:
logP teoretic (3-clorobenzamidă) = 1,35 logP experimental (3-clorobenzamidă) = 1,51
Constanta sterică Taft
Descriptor al obstacolului steric al unei grupări substituente. Definit de Taft în 1952 pe baza ratei de hidroliză a esterilor acetici substituiți.
Notă
- ^ Substituent , la merriam-webster.com , Enciclopedia Meriam-Webster.
- ^ Substituent , pe droguri.com . Adus la 4 mai 2019 (arhivat din original la 4 martie 2016) .
- ^ Substituent atom (group) , at goldbook.iupac.org , IUPAC Gold Book.
Elemente conexe
linkuri externe
- Relația structură cantitativă - activitate (QSAR) , drtchemistry.com