Legături intermoleculare
Legăturile intermoleculare sunt interacțiuni electrostatice care sunt generate nu între atomi unici, ci între molecule neutre și ioni . [1] Aceste interacțiuni pot fi cauzate atât de molecule al căror moment dipolar rezultat este diferit de zero, cât și de molecule care suferă polarizare , dar sunt în general caracterizate printr-o energie mai slabă decât legăturile intramoleculare . [2] [3] Acestea devin deseori fundamentale în determinarea proprietăților fizice și chimice ale anumitor substanțe sau în domenii precum andocarea unui medicament. [4] [3]
Descriere
Forțele intermoleculare pot fi atractive sau respingătoare și apar între două sau mai multe molecule, care pot fi aceleași, dacă substanța este pură sau diferită una de cealaltă, în cazul unui amestec sau dacă este luată în zona de separare între două materiale. [3]
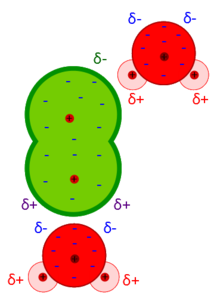
Acest tip de forțe apare între molecule în care centrul de greutate al sarcinilor negative nu coincide cu centrul de greutate al sarcinilor pozitive. Acest lucru se datorează faptului că unele molecule au un moment dipol rezultat diferit de zero și, prin urmare, se comportă ca dipoli electrici slabi.
Forțele intermoleculare ajută la determinarea unor caracteristici fizice ale substanțelor. În interiorul unui gaz , de exemplu, moleculele sunt la astfel de distanțe încât forța va fi mică în medie, deoarece acestea au o energie cinetică ridicată. Prin urmare, acest lucru permite extinderea gazului până când acesta ocupă întotdeauna întregul volum la dispoziție. [5] Dimpotrivă, în stare lichidă (și cu atât mai mult în stare solidă ) aceste interacțiuni sunt mai puternice și, prin urmare, determină o compacitate mai mare a substanței, împreună cu o mobilitate mai mică a moleculelor. [1]
Prin urmare, forțele intermoleculare vor determina care vor fi proprietățile fizice ale unei substanțe, în special în schimbările de stare care implică lichide (solid-lichid și lichid-gaz). [6] O forță mare între moleculele unei soluții (de exemplu o legătură de hidrogen, ca în cazul apei) ridică punctul de fierbere al acesteia, deoarece capacitatea de a aduce moleculele în faza de vapori este mai scumpă din punct de vedere energetic ( furnizând probabil energie sub formă de căldură) pentru a rupe aceste legături. Același lucru se poate spune și pentru punctul de topire. [7]
Forțele Van der Waals
Forțele van der Waals, numite după fizicianul olandez Johannes Diderik van der Waals , sunt un set de interacțiuni intermoleculare care include forțele londoneze și interacțiunile dipol-dipol . [6] Forțele Van der Waals sunt interacțiuni care implică atât molecule polare cât și nepolare , aparținând stării lichide și solide a materiei și fac ca moleculele aparținând acestor două stări de agregare să fie mai compacte și mai puțin mobile. [8]
Forțele Van der Waals pot apărea atunci când apar:
- o atracție între dipoli permanenți (în acest caz se numește interacțiunea Keesom );
- o atracție între dipolul permanent și dipolul indus (în acest caz se numește forța Debye );
- o atracție între dipolul instantaneu și dipolul indus (în acest caz vorbim despre forța londoneză ) [9]
Forța de dispersie din Londra
Forțele londoneze, numite după fizicianul Fritz London , sunt cel mai slab tip de interacțiune intermoleculară și apar din cauza deplasării temporare a încărcăturilor care formează norul de electroni al unei molecule. Aceasta înseamnă că forțele londoneze sunt generate și între moleculele apolare sau între gazele nobile , deoarece în atomi (sau molecule) în care distribuția sarcinii este în medie simetrică, nu este instantaneu. [4] În consecință, provine instantaneu o moleculă cu o sarcină electrică slabă, adică un dipol instantaneu, care dă naștere unui câmp electric care influențează și polarizează prin inducția atomilor din jur, respectivii dipoli induși. Efectul de lanț care se creează generează legături de moment între atomi, care, luați împreună, pot suprapune în mod semnificativ orice alte forțe intermoleculare sau interionice. [10]
Efectul atractiv care apare între diferiții dipoli este cuantificat prin energia E exprimată în ecuația de la Londra:
în funcție de polarizabilitatea α , energia de ionizare E i și distanța r. [4] Se poate observa că această energie nu este neglijabilă doar pentru distanțe extrem de mici, motiv pentru care aceste interacțiuni sunt numite și forțe cu rază scurtă de acțiune.
Forțele londoneze sunt singurele forțe care acționează între moleculele de gaze nobile și le permit să existe chiar și în stare lichidă, în plus, sunt capabile să influențeze proprietăți precum temperatura de fierbere sau densitatea unor substanțe, de exemplu hidrocarburi . [3] [11]
Mai mult, acestea sunt numite și forțe de dispersie, deoarece fenomenul care stă la baza naturii lor generează, de asemenea, dispersia luminii de către molecule. [12]
Puterea lui Debye
Forțele Debye, numite și forțe de inducție, sunt foarte slabe și apar între o moleculă polară și o nepolară. [11] Datorită apropierii de un ion, de fapt, un moment dipolar indus este generat într-o moleculă apolară, cu o intensitate direct proporțională cu câmpul electric generat de ion. Energia exercitată urmează relația:
unde μ măsoară intensitatea momentului dipol permanent, α ' volumul de polarizare a moleculei și ε 0 corespunde constantei dielectrice a vidului . [13]
Interacțiunea Keesom
Aceste interacțiuni electrostatice, numite și interacțiuni dipol-dipol, apar între două molecule ambele cu propriul moment dipolar, care tind să se aranjeze în așa fel încât să se apropie de polii sarcinii opuse. [11]
Configurația astfel realizată tinde să fie foarte stabilă, mai ales dacă forțele sunt intense. Acest lucru nu se întâmplă, de exemplu, în gaze, în care distanțele intermoleculare sunt prea mari pentru ca contribuția interacțiunilor Keesom să fie relevantă, de asemenea datorită agitației puternice a particulelor care tinde să rupă structura ordonată. [11] Numai prin scăderea temperaturii sau creșterea presiunii, distanțele dintre molecule scad și există o consecință a creșterii coeziunii dintre ele, tocmai datorită acestor forțe, care pot duce și la trecerea la starea lichidă. În mod similar, pentru temperaturi chiar mai scăzute sau presiuni chiar mai mari, există trecerea la starea solidă, caracterizată printr-o stabilitate și mai mare. [14]
Interacțiunea Keesom poate fi cuantificată în două moduri diferite, în funcție de starea substanțelor implicate:
- În cazul unei substanțe lichide sau gazoase, în care dipolii se pot roti, avem
unde k corespunde constantei Boltzmann , μ 1 și μ 2 momentelor dipolare ale celor două molecule, ε 0 constantei dielectrice în vid și r distanței dintre cei doi dipoli.
- În cazul unei substanțe solide, în care dipolii sunt staționari, se obține
unde θ 1 , θ 2 și φ sunt unghiurile care caracterizează orientarea reciprocă între cei doi dipoli. [14]
Legătură de hidrogen

Unele lichide au puncte de fierbere mult mai mari decât valorile așteptate, având în vedere doar interacțiunile dipolare , acest lucru indicând oamenilor de știință prezența forțelor intermoleculare mai pronunțate. În special, a fost descoperită o forță de atracție între molecule, datorită legăturii de hidrogen . În moleculele în care un atom de hidrogen este legat de unul sau mai mulți atomi electronegativi mici ( azot , oxigen sau fluor ), acest efect este prezent. De fapt, prezența unui atom electronegativ puternic, legat covalent de un hidrogen creează un dipol puternic, în care atomul de hidrogen reprezintă partea pozitivă. Această dispunere a atomilor produce o legătură foarte polară, deci o moleculă polară cu interacțiuni puternice de atracție intermoleculară. Deși legătura de hidrogen este mai slabă decât legăturile prezente în interiorul moleculelor (legături intramoleculare), aceasta este cea mai mare forță de atracție dintre molecule (forțe intermoleculare). [6] Acest lucru este demonstrat de faptul că energia sa de legare (între 20 și 50 kJ / mol ) este semnificativ mai mare decât cea a celorlalte forțe intermoleculare. [16] Protonația atomului de hidrogen (H → H + ) este de așa natură încât să-i permită să lege, cu o legătură electrostatică , un alt atom electronegativ. Exemplele sunt compușii chimici precum apa (H 2 O), amoniacul (NH 3) ) și fluorură de hidrogen (HF). [16] Legătura de hidrogen are o influență extrem de importantă asupra comportamentului multor sisteme biologice. Moleculele precum proteinele și ADN necesită o rețea de legături de hidrogen pentru a-și menține structurile și funcțiile. [6] De fapt, în ADN legăturile de hidrogen dintre bazele azotate ale celor două filamente sunt responsabile pentru structura dublei spirale. Chiar dacă energia necesară pentru a sparge legătura unică de hidrogen este mică, în condiții fiziologice structura dublei spirale este stabilizată de numărul foarte mare de legături de hidrogen prezente. [15]
Interacțiunea ion-dipol
Interacțiunea dintre ioni și dipoli, în general între 40- 600 kJ / mol , apare în interiorul soluțiilor de substanțe dizolvate ionice în special solvenți polari, deoarece moleculele solventului tind să se comporte ca dipoli electrici, în timp ce solutul este disociat în ioni pozitivi și negativi. [10]
Un exemplu foarte simplu al acestei atracții este dat de dizolvarea sării de masă în apă: sarea este formată din ioni de sodiu Na + și clor Cl - , care generează fiecare un câmp electric care permite asimilarea moleculelor de apă cu dipoli electrici, atrage fiecare ion. [17]
În general, această forță este adesea depășită atât de coliziuni moleculare, cât și de mișcări termice, chiar dacă unele metale de tranziție sunt capabile să formeze legături covalente reale (cu unele molecule) datorită ionilor lor, formând astfel compuși de coordonare. , De compuși deosebit de stabili. [18]
Această interacțiune poate fi cuantificată și prin diferența de energie liberă Gibbs calculată între cazurile în care există și nu există astfel de interacțiuni, dar numai dacă ipoteza diluției infinite este valabilă. [3]
Legătură halogenă
Legătura halogenă este o interacțiune non-covalentă care se stabilește între un atom de halogen legat covalent , care acționează ca un electrofil și o specie nucleofilă . [19] Este o legătură polară carbon- halogen puternică (puterea sa este cuprinsă între 5 și 180 KJ / mol ), datorită faptului că legătura are loc între doi ioni, prin urmare poate fi semnificativ mai puternică decât legătura hidrogen. Toți halogenii pot forma această legătură, deși fluorul este mai rar implicat. [20]
Legarea la halogen este una dintre proprietățile halogenurilor de alchil , din care determină reactivitatea . De fapt, atomul electronegativ al halogenului creează o legătură CX (unde C reprezintă atomul de carbon și X cea a unui halogen) polar, făcând astfel atomul de carbon sărac în electroni. Polaritatea acestei legături va determina, de asemenea, chimia în sine a halogenurilor de alchil. [21] Prin urmare, un exemplu al acestei interacțiuni poate fi văzut în reacția halogenurilor de alchil cu un nucleofil:
CH 3 C + H 2 -Cl (-) +: Nu -
În cazul în care carbonul (al doilea din formula reprezentată aici) este încărcat ca un ion pozitiv (electrofil sau sărac în electroni) printr-o interacțiune intramoleculară non-covalentă datorită prezenței halogenului (în acest caz clor ) și, prin urmare, reacționează cu un nucleofil bogat în electroni (în acest caz reprezentat generic). [22]
Notă
- ^ a b Legături intermoleculare și forțe Van der Waals , pe chemical-online.it . Adus 25/04/19 la 12:30 PM .
- ^ Elemente de chimie - Roberto Spinicci - Firenze University Press , pp. 225-226.
- ^ a b c d e Legături intermoleculare [ link rupt ] , pe chimicando.altervista.org . Adus 24-04-2019 19:15 .
- ^ a b c Malucelli, Giulio., Elemente de chimie pentru inginerie , biblioteca universitară Levrotto & Bella, 2002, p. 145.
- ^ Elemente de chimie - Roberto Spinicci - Firenze University Press , p. 238.
- ^ a b c d Elisabetta Brenna, Paola D'Arrigo și Giuseppina Raffaini, 5.2.4 , în Fundamentals of Chemistry and Organic Chemistry for Biomedical Engineering , Mc Graw-Hill Education, 2015, p. 233.
- ^ Legături intermoleculare , pe gmpe.it. Adus 21-04-2019 19:20 .
- ^ Intermolecular Bonds and Van der Waals Forces , pe chemical-online.it . Adus pe 3 mai 2019 .
- ^ Legături intermoleculare , pe gmpe.it. Adus la 6 mai 2019 .
- ^ a b Elemente de chimie - Roberto Spinicci - Florence University Press , p. 227.
- ^ a b c d Elemente de chimie pentru inginerie - Giulio Malucelli - Nerino Penazzi 2002 Levrotto & Bella di Gualini, Torino , p. 146.
- ^ Elemente de chimie pentru inginerie - Giulio Malucelli - Nerino Penazzi 2002 Levrotto & Bella di Gualini, Torino , p. 145.
- ^ Interacțiune dipol permanent - dipol indus pe chimica-online.it. Adus pe 3 mai 2019 la 22:08 .
- ^ a b Interacțiunea dipol-dipol , pe chemical-online.it .
- ^ a b Legătură de hidrogen , pe whatischemistry.unina.it . Adus la 8 mai 2019 .
- ^ a b Legătură de hidrogen , pe chemical-online.it . Adus la 8 mai 2019 .
- ^ Malucelli Giulio, Nerino Penazzi, Elements of Chemistry for Engineering , p. 147.
- ^ Elemente de chimie - Roberto Spinicci - Firenze University Press , p. 228.
- ^ Gabriella Cavallo, Francesca Baldelli Bombelli, Pierangelo Metrangolo, Tullio Pilati, Giuseppe Resnati, Giancarlo Terraneo, Bine ați venit la primul simpozion internațional privind legarea halogenului ( PDF ), pe soc.chim.it.
- ^ P. Politzer, P. Lane, MC Concha, Y. Ma, JS Murray, O privire de ansamblu asupra legăturii cu halogen , în J. Mol. Model. , vol. 13, n. 2, 2007, pp. 305-11, DOI : 10.1007 / s00894-006-0154-7 , PMID 17013631 .
- ^ Elisabetta Brenna, Paola D'Arrigo și Giuseppina Raffaini, 7.4 , în Fundamentals of Chemistry and Organic Chemistry for Biomedical Engineering , Mc Graw-Hill Education, 2015, p. 528.
- ^ Elisabetta Brenna, Paola D'Arrigo și Giuseppina Raffaini, 3.5 , în Fundamentals of Chemistry and Organic Chemistry for Biomedical Engineering , Mc Graw-Hill Education, 2015, p. 248-249.
Bibliografie
- Roberto Spinicci, Elemente de chimie, Firenze University Press, 2009, ISBN 978-88-6453-064-2
- Giulio Malucelli, Nerino Penazzi, Elemente de chimie pentru inginerie, Levrotto & Bella, Torino, 2006, ISBN 88-8218-085-9
- Maria Elisabetta Brenna, Paola D'Arrigo și Giuseppina Raffaini, Fundamentals of Chemistry and Organic Chemistry for Biomedical Engineering , Mc Graw-Hill Education, 2015, ISBN 978-1-3085-7836-1 .
Elemente conexe
- Legătură chimică
- Moleculă
- Dipol molecular
- Inginerie Chimica
- Johannes Diderik van der Waals
- Rezistența intramoleculară
linkuri externe
- ( EN ) Legături intermoleculare , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
| Controlul autorității | LCCN (EN) sh85067312 · GND (DE) 4191346-2 · NDL (EN, JA) 00.576.112 |
|---|