Urat oxidaza
| urat oxidază | |
|---|---|
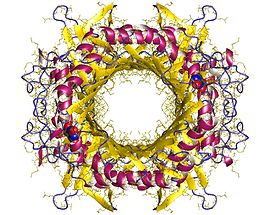 Tetramer de urat oxidază, Aspergillus flavus | |
| Numărul CE | 1.7.3.3 |
| Clasă | Oxidoreductaza |
| Numele sistematic | |
| urat: oxigenoreductază | |
| Alte nume | |
| acid uric oxidază; uricază; uricaza II | |
| Baze de date | BRENDA , EXPASY , GTD , PPB ( RCSB PPB PDBe PDBj PDBsum ) |
| Sursa: IUBMB | |
Uratul oxidază (sinonim: uricază ) este o enzimă , aparținând clasei oxidoreductazelor , care este prezentă în peroxizomii multor organisme (dar nu și ale omului) și este activă în catabolismul purinelor . Catalizează oxidarea acidului uric la 5-hidroxiurat . Produsul de reacție este instabil și se transformă spontan în alantoină , totuși in vivo există o enzimă, 5-hidroxiurat hidrolaza care catalizează prima etapă a acestei reacții, crescând viteza acesteia.
Uroxidaza joacă, de asemenea, un alt rol metabolic în metabolismul ureidelor la plantele care formează noduli rădăcini (leguminoase). Azotul este transformat în metaboliți care sunt transportați de rădăcini prin plantă , pentru a alimenta planta cu azot, necesar de exemplu pentru sinteza aminoacizilor .
Reacţie
Reacția urmează următoarea ecuație:
Urat + O 2 + H 2 O ⇌ 5- hydroxyurate + H 2 O 2
Peroxidul produs este ușor catabolizat de peroxizomii peroxidaze .
Mecanism de reacție
Deși unele studii au indicat prezența ionilor de cupru , alte studii au arătat absența ionilor metalici, făcându-l singura oxidază care nu necesită nici ioni metalici, nici cofactori organici pentru cataliză . Există posibilitatea ca enzimele din diferite organisme să utilizeze mecanisme de reacție diferite, dintre care unele necesită ioni de cupru, în timp ce altele nu.
Structura
Structurile tridimensionale ale uratului oxidazic al Aspergillus flavus și Bacillus SP. TB-90 au fost studiate prin intermediul cristalografiei cu raze X. Enzima este un homotetramer care conține patru situri active identice situate la interfața dintre subunitățile sale.
Enzima are un număr variabil de aminoacizi în funcție de specie, care este de aproximativ 300 de reziduuri, cu o greutate moleculară de aproximativ 35 kg dalton .
Distribuție
Deși uratul oxidazic este prezent în aproape toate organismele vii, bacterii , ciuperci , plante , animale , este absent la multe primate și în special la om . Există o genă pentru uratul oxidază în genomul uman , redată nefuncțională prin două mutații . Având în vedere absența uratului oxidazei, acidul uric este produsul final al catabolismului purinic la om: s-a emis ipoteza că pierderea enzimei a fost un avantaj pentru primatele superioare, deoarece acidul uric este un puternic antioxidant , a cărui prezență protejează împotriva atacului radicalii liberi , prelungind speranța de viață și scăzând incidența tumorilor [ fără sursă ] .
Utilizări terapeutice
Prezența concentrațiilor ridicate de acid uric în sânge provoacă gută . Uratul oxidază purificat de la Aspergillus flavus , sub denumirea comercială de uricozimă, și uratul oxidază recombinantă, sub denumirea comercială de rabsuricază , au fost utilizate pentru tratamentul gutei, în special în cazul hiperuricemiei la pacienții tratați cu chimioterapie .
Bibliografie
- London, M. și Hudson, PB Purificarea și proprietățile uricazei solubilizate. Biochim. Biofizi. Acta 21 (1956) 290–298. Entrez PubMed 13363909
- Mahler, HR, Hübscher, G. și Baum, H. Studii asupra uricazei. I. Prepararea, purificarea și proprietățile unei cuproproteine. J. Biol. Chem. 216 (1955) 625-641. Entrez PubMed 13271340
- Robbins, KC, Barnett, EL și Grant, NH Purificare parțială a ficatului uricazic porcin. J. Biol. Chem. 216 (1955) 27-35. Entrez PubMed 13252004
- Kahn, K. și Tipton, PA Caracterizarea spectroscopică a intermediarilor în reacția urat oxidazei. Biochimie 37 (1998) 11651–11659. Entrez PubMed 9709003
- Colloc'h, N., el Hajji, M., Bachet, B., L'Hermite, G., Schiltz, M., Prange, T., Castro, B. și Mornon, J.-P. Structura cristalină a complexul proteic medicament urat oxidază-inhibitor la rezoluție 2,05 Å. Nat. Struct. Biol. 4 (1997) 947-952. Entrez PubMed 9360612
- Imhoff, RD, Power, NP, Borrok, MJ și Tipton, PA Cataliză generală a bazei în reacția urat oxidazei: dovezi pentru un diad catalitic Thr-Lys nou. Biochimie 42 (2003) 4094–4100. Entrez PubMed 12680763