Experimentul Rutherford
Experimentele lui Geiger și Marsden (denumite în mod necorespunzător experimentul Rutherford al foliei de aur ) au fost o serie istorică de experimente prin care oamenii de știință au descoperit că fiecare atom are un nucleu în care se concentrează toată încărcătura sa pozitivă și cea mai mare parte din masă . Au dedus acest lucru măsurând modul în care un fascicul de particule alfa este împrăștiat atunci când lovește o foaie subțire de metal.
Aceste experimente au fost efectuate în perioada 1908-1913 de Hans Geiger și Ernest Marsden sub conducerea lui Ernest Rutherford în laboratoarele de fizică ale Universității din Manchester . Singurul experiment de împrăștiere realizat de Rutherford însuși a avut loc, de fapt, în 1906 și a folosit o placă fotografică ca detector de particule difuze. Prin urmare, modelul anterior al lui Thomson a fost depozitat. Noul model, numit modelul atomic Rutherford , a contrastat însă cu prevederile legilor electrodinamicii clasice și a pus bazele construcției modelului său atomic de către Niels Bohr, care poate fi explicată prin mecanica cuantică , contribuind astfel la crearea -sumată teorie cuantică veche .
rezumat
Teorii despre structura atomică a timpului
Cea mai cunoscută teorie a structurii atomice la momentul experimentului lui Rutherford a fost „ modelul panettone ”. Acest model a fost conceput de Lord Kelvin și dezvoltat în continuare de JJ Thomson , omul de știință care a descoperit electronul . Thomson credea că atomul era o sferă încărcată pozitiv în interiorul căreia erau distribuiți electronii, cam ca stafidele din panettone . La acea vreme, nici protoni, nici neutroni nu fuseseră încă descoperiți. Se știe că atomii sunt foarte mici (Rutherford a presupus că aveau o rază de ordinul a 10 −8 m [1] ). Acest model s-a bazat în întregime pe fizica clasică (newtoniană); modelul acceptat în prezent se bazează pe mecanica cuantică .
Modelul lui Thomson nu a fost universal acceptat nici înainte de experimentele lui Rutherford. Thomson însuși nu a reușit niciodată să dezvolte un model complet și stabil al ideii sale. Omul de știință japonez Hantaro Nagaoka a respins modelul lui Thomson pe motiv că acuzațiile opuse nu se pot pătrunde reciproc. [2] În schimb, el a emis ipoteza că electronii orbitează în jurul sarcinii pozitive, precum inelele din jurul lui Saturn . [3]
Implicațiile modelului panettone
O particulă alfa este o particulă încărcată pozitiv. Conform modelului lui Thomson, dacă o particulă alfa ar coliziona cu un atom, aceasta ar trece prin el și ar fi deviată cel mult cu o fracțiune de grad. Acest lucru se datorează faptului că, la scară atomică, conceptul de „impenetrabilitate” a materiei nu are niciun sens și particula alfa nu ar sări de pe atom ca și cum ar fi o marmură, ci ar fi afectată doar de câmpul electric al atomilor. În acest cadru, modelul lui Thomson a prezis că câmpul electric dintr-un atom era prea slab pentru a afecta mișcarea unei particule alfa (particulele alfa tind să se miște foarte repede). În interiorul atomului Thomson, atât sarcinile pozitive, cât și cele negative sunt răspândite pe întregul volum al atomului. Conform legii lui Coulomb , dacă sarcina electrică ar fi concentrată într-un punct, modulul câmpului electric generat de acesta ar deveni infinit apropiindu-se de punct; dacă, pe de altă parte, aceeași sarcină este distribuită omogen în interiorul unei sfere, modulul câmpului electric generat de aceasta presupune o valoare maximă care este atinsă la suprafață. [4] [5]
De exemplu, considerați o particulă alfa care trece tangențial la un atom de aur, unde suferă valoarea maximă a câmpului electric și, prin urmare, deviația maximă . Deoarece electronii sunt foarte ușori în comparație cu particulele alfa, influența lor poate fi neglijată [6], iar atomul, în modelul lui Thomson, poate fi considerat o sferă grea încărcată pozitiv. Avem următoarele valori:
- : sarcina pozitivă a atomului de aur, egală cu
- : sarcina particulei alfa, peri a
- : raza atomului de aur
- : viteza particulei alfa
- : masa particulei alfa, egală cu
- Constanta lui Coulomb .
Folosind fizica clasică, variația laterală a impulsului particulei alfa poate fi aproximată folosind definiția impulsului și expresia forței Coulomb :
Calculul de mai sus nu este altceva decât o aproximare a ceea ce se întâmplă atunci când o particulă alfa se apropie de un atom Thomson, dar este clar că devierea este cel mult de ordinul unei mici fracțiuni de grad. Dacă o particulă alfa a traversat o folie de aur cu o grosime de aproximativ 0,0004 cm (2410 atomi) [7] și dacă, din toți atomii de aur întâlniți în calea sa, particula a suferit deformarea maximă posibilă întotdeauna în aceeași direcție (succesiune foarte puțin probabilă de evenimente) ), la ieșirea din folie, deviația generală față de traiectoria de intrare ar fi încă mică.
Rezultatul experimentelor
Sub conducerea lui Rutherford, Geiger și Marsden au efectuat o serie de experimente în care au îndreptat un fascicul de particule alfa către o foaie subțire de metal și au măsurat modelul de împrăștiere folosind un ecran fluorescent . Au observat că particulele alfa au fost deviate de folie în toate direcțiile, unele înapoi spre sursă. Acest lucru ar trebui să fie imposibil conform modelului lui Thomson; particulele alfa ar trebui să traverseze placa neperturbată. Evident, acele particule s-au confruntat cu o forță electrostatică mult mai mare decât cea prezisă de modelul lui Thomson, ceea ce a dus, prin urmare, să credem că sarcina pozitivă a atomului este concentrată într-un volum mult mai mic decât își imagina Thomson. [8]
Geiger și Marsden au observat că doar o mică parte din particulele alfa au fost deviate cu mai mult de 90 °. Cea mai mare parte a trecut direct prin lamina. Acest fapt a sugerat că acele mici sfere cu sarcină pozitivă intensă erau separate de spații goale vaste. [8]
Prin urmare, Rutherford a respins modelul de atom al lui Thomson și, în schimb, a propus un model în care atomul este alcătuit în mare parte din spațiu gol, cu sarcina pozitivă concentrată în centrul său într-un volum foarte mic, înconjurat de un nor de electroni.
Istorie
Context
Ernest Rutherford a fost profesor de fizică Langsworthy la Universitatea Victoria din Manchester [9] (acum Universitatea din Manchester ). El primise deja numeroase premii pentru studiile sale de radiații. Descoperise existența razelor alfa , beta și gamma , și arătase că acestea erau consecința dezintegrării atomilor . În 1906, a primit vizita unui fizician german pe nume Hans Geiger și a fost atât de impresionat încât i-a cerut lui Geiger să rămână pentru a-l ajuta cu cercetările sale.[10] Ernest Marsden a fost student la fizică la conducerea lui Geiger.
Particulele alfa sunt particule mici, încărcate pozitiv, care sunt emise spontan de anumite substanțe, cum ar fi uraniul și radiul . Rutherford le-a descoperit în 1899. În 1908, el încerca să măsoare cu precizie raportul încărcare-masă. Pentru a face acest lucru, mai întâi a trebuit să știe câte particule alfa au fost emise de proba sa de radio (după care ar măsura încărcătura totală și s-ar împărți una cu cealaltă). Particulele alfa sunt prea mici pentru a fi văzute cu microscopul, dar Rutherford știa că particulele alfa ionizează moleculele de aer și, dacă aerul se află în interiorul unui câmp electric, ionii produc un curent electric. Pe baza acestui principiu, Rutherford și Geiger au proiectat un dispozitiv simplu de numărare care consta din doi electrozi într-un tub de sticlă. Fiecare particulă alfa care trece prin tub creează un impuls de electricitate care poate fi numărat. Era o versiune primitivă a tejghelei Geiger .[10]
Contorul pe care Geiger și Rutherford l-au construit s-au dovedit a fi fiabile, deoarece particulele alfa au fost deviate prea puternic de coliziunile lor cu moleculele de aer din camera de detecție. Faptul traiectoriilor extrem de variabile ale particulelor alfa înseamnă că nu toți generează același număr de ioni pe măsură ce trec prin gaz, producând astfel citiri imprevizibile. Acest lucru l-a surprins pe Rutherford pentru că el credea că particulele alfa erau prea grele pentru a fi deviate atât de puternic. Rutherford i-a cerut lui Geiger să investigheze cât de multă materie poate dispersa razele alfa. [11]
Experimentele concepute au presupus bombardarea unei folii metalice cu particule alfa pentru a observa modul în care folia le-a dispersat în raport cu grosimea și tipul de material. Au folosit un ecran fluorescent pentru a măsura traiectoria particulelor. Fiecare impact al particulelor alfa de pe ecran a produs un mic fulger de lumină. Geiger a lucrat într-un laborator în întuneric ore întregi, numărând aceste mici scintilații cu un microscop. [5] Rutherford a lăsat această slujbă colegilor săi mai tineri, deoarece nu avea rezistența necesară. [12] Pentru folia metalică, au încercat o varietate de metale, dar au preferat aurul, deoarece ar putea face o folie foarte subțire, deoarece aurul este foarte maleabil. [13] Ca sursă de particule alfa, substanța preferată de Rutherford a fost radonul , de multe milioane de ori mai radioactiv decât uraniul.
Experimentul din 1908
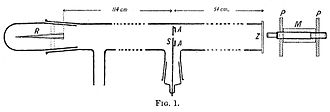
O lucrare din 1908 a lui Geiger, Despre împrăștierea particulelor a prin materie , [14] descrie următorul experiment. A construit un tub lung de sticlă, lung de aproape doi metri. La un capăt al tubului, exista o cantitate de „emanație de radiu” ( radon -222, notat R în figură) care servea ca sursă de particule alfa. Capătul opus al tubului a fost acoperit cu un ecran fosforescent (Z). În mijlocul tubului era o fantă mare 0,99 mm . Particulele alfa din R au trecut prin fantă și au creat un punct luminos pe ecran. Un microscop (M) a fost folosit pentru a număra scintilațiile de pe ecran și pentru a măsura dispersia acestora. Geiger a aspirat tot aerul din tub, astfel încât particulele alfa să rămână neperturbate și a lăsat pe ecran o imagine clară care să se potrivească cu forma fantei. Apoi Geiger a lăsat puțină aer în tub și figura luminoasă a devenit mai difuză. Geiger a aspirat din nou aerul și a așezat un film de aur peste fanta AA. Acest lucru a provocat, de asemenea, o cifră pe ecran mai răspândită. Acest experiment a arătat că atât aerul cât și materia solidă pot dispersa în mod evident particule alfa. Cu toate acestea, aparatul nu a putut observa decât devierea unghiurilor mici. Rutherford a vrut să știe dacă particulele alfa erau împrăștiate la unghiuri și mai mari - poate mai mari de 90 de grade.
Experimentul din 1909
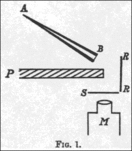
Într-o lucrare din 1909, Pe o reflecție difuză a particulelor α , [15] Geiger și Marsden descriu experimentul cu care au demonstrat că particulele alfa pot fi de fapt deviate cu un unghi mai mare de 90 °. În experimentul lor, ei pregătesc un mic tub de sticlă conic (AB) care conține „emanație de radiu” ( radon ), „radiu A” ( radiu real) și „radiu C” ( bismut -214); capătul deschis a fost sigilat cu mica . Acesta a fost emițătorul lor de particule alfa. Apoi au așezat o placă de plumb (P), în spatele căreia au plasat un ecran fluorescent (S). Tubul a fost ținut pe partea opusă a plăcii, astfel încât particulele alfa emise să nu lovească direct ecranul. Au observat puțină sclipire pe ecran în timp ce unele particule alfa au ocolit placa și au sărit de pe moleculele de aer. Apoi au așezat o foaie de metal (R) pe partea laterală a foii de plumb. Au îndreptat tubul spre folie pentru a vedea dacă particulele alfa au sărit și au lovit ecranul de cealaltă parte a plăcii și au observat o creștere a numărului de scintilații pe ecran. Numărând scintilațiile, au observat că metalele cu mase atomice mai mari, cum ar fi aurul, reflectă mai multe particule alfa decât cele mai ușoare, cum ar fi aluminiul.
Geiger și Marsden au dorit atunci să estimeze numărul total de particule alfa care au fost reflectate. Aparatul nu era potrivit pentru acest lucru, deoarece tubul conținea multe substanțe radioactive (radiu și produsele sale de degradare) și, prin urmare, particulele alfa emise aveau intervale diferite și pentru că le era dificil să se stabilească cu ce ritm tubul emitea particule alfa. De data aceasta, au plasat o cantitate mică de radiu C (bismut-214) pe placa de plumb, care a sărit de pe un reflector de platină (R) și pe ecran. Au descoperit că doar o mică parte din particulele alfa care au lovit reflectorul au sărit de pe ecran (în acest caz, 1 din 8000). [15]
Experimentul din 1910
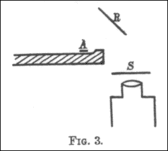
Un articol din 1910 [16] al lui Geiger, Scattering of the α-Particles by Matter , descrie un experiment prin care a încercat să măsoare modul în care cel mai probabil unghi prin care este deviată o particulă α variază în funcție de materialul prin care trece, grosimea materialului menționat și viteza particulelor. A construit un tub de sticlă din care a aspirat aerul. La un capăt era un bec (B) care conținea „emanație de radiu” ( radon -222). Datorită mercurului, radonul din B a fost pompat de-a lungul tubului de sticlă îngust al cărui capăt în A a fost închis cu mica . La celălalt capăt al tubului era un ecran fluorescent cu sulfură de zinc (S). Microscopul pe care l-a folosit pentru a număra scintilațiile de pe ecran a fost aplicat pe o scară verticală milimetrică cu un etrier , ceea ce i-a permis lui Geiger să măsoare cu precizie unde au apărut fulgerele de lumină pe ecran și apoi să calculeze unghiurile de deviere ale particulelor. Particulele alfa emise de A au fost colimate de o mică gaură circulară la D. Geiger a plasat o placă metalică de-a lungul traseului razelor la D și E pentru a observa cum se schimbă zonele fulgerului. De asemenea, el ar putea varia viteza particulelor alfa plasând straturi suplimentare de mică sau aluminiu la A.
Din măsurătorile pe care le-a făcut, Geiger a ajuns la următoarele concluzii:
- cel mai probabil unghi de deviere
- crește odată cu grosimea materialului
- este proporțională cu masa atomică a substanței
- scade odată cu viteza particulelor alfa
- probabilitatea ca o particulă să fie deviată cu mai mult de 90 ° este aproape nulă.
Rutherford modelează matematic figura împrăștiată
Având în vedere rezultatele rezultatelor de mai sus, Rutherford a publicat în 1911 un articol istoric intitulat „Scattering of α and β Particles by Matter and the Structure of the Atom” în care propunea că atomul conține în centrul său un volum de încărcare electrică care este foarte mic și intens (de fapt, Rutherford o tratează ca o sarcină punctuală în calculele sale). [1] În scopul calculelor sale, el a presupus că această sarcină centrală este pozitivă, dar a recunoscut că nu a putut dovedi de ce și că a trebuit să aștepte mai multe experimente pentru a-și dezvolta teoria.
Rutherford a dezvoltat o ecuație matematică care a modelat modul în care folia ar devia particulele alfa dacă toată sarcina pozitivă și cea mai mare parte a masei atomice ar fi concentrate într-un singur punct în centrul unui atom.
unde este:
- este numărul de particule alfa care lovesc o unitate de suprafață la un unghi de deviere
- este distanța de la punctul de incidență al razelor pe material
- este numărul total de particule care lovesc materialul
- este numărul de atomi dintr-o unitate de volum a materialului
- este grosimea foliei
- este sarcina pozitivă a nucleului atomic
- este sarcina pozitivă a particulelor alfa
- este masa unei particule alfa
- este viteza unei particule alfa.
Din datele de împrăștiere, Rutherford a estimat că taxa centrală este de aproximativ +100 unități (vezi intrarea de pe modelul atomic Rutherford ).
Concluzii
Rutherford a interpretat rezultatele experimentale într-o lucrare din 1911 intitulată „Scattering of α and β Particles by Matter and the Structure of the Atom” ( „Răspândirea particulelor α și β și structura atomului”). [1]
S-a constatat că marea majoritate a particulelor au trecut prin lamă fără a suferi abateri, dar un anumit număr dintre ele a suferit abateri mai mult sau mai puțin consistente, între 1 ° și 90 °, iar aproximativ 1 din 10.000 au fost deviate la unghiuri mai mari de 90 ° . Prin urmare, a declarat că:
| ( EN ) „Pentru concretitate, luați în considerare trecerea unei particule alfa de mare viteză printr-un atom având o sarcină centrală pozitivă N e și înconjurată de o sarcină compensatoare de N electroni.” | ( IT ) „Pentru concretitate, să luăm în considerare trecerea unei particule alfa la viteză mare printr-un atom care are o sarcină pozitivă centrală N și este înconjurat de sarcina de N electroni pentru a compensa”. |
| ( Ernest Rutherford , împrăștierea particulelor α și β după materie și structura atomului ) | |
În articol, Rutherford a respins definitiv „modelul panettone” al lui Thomson , întrucât conform acestui model nici particulele încărcate negativ, adică electronii , nici distribuția sarcinii pozitive care urma să le conțină nu ar fi putut produce astfel de deviații marcate. El a demonstrat, de asemenea, existența nucleului atomic , teoretizat de Hantarō Nagaoka în „modelul său saturnian”, în timp ce infirmă stabilitatea unui posibil inel de electroni care orbitează în jurul său. Cu toate acestea, nucleul era extrem de mic în comparație cu ceea ce fusese teoretizat până în acel moment, fiind de aproximativ 100.000 de ori mai mic decât atomul în sine, făcând atomul în esență gol.
Rutherford a folosit legile mecanicii clasice pentru calculele sale, deoarece teoria cuantică nu era disponibilă în acel moment. Acest experiment și incompatibilitatea ulterioară a modelului atomic al lui Rutherford cu teoria clasică a electromagnetismului , au condus la formularea de către Bohr a unui nou model atomic care a stat la baza primelor teorii cuantice . Prin calcule bazate pe teoria cuantică obținem același rezultat găsit de Rutherford.
Notă
- ^ a b c Rutherford 1911 .
- ^ Daintith și Gjertsen 1999 .
- ^ Nagaoka 1904 .
- ^ Hiperfizică .
- ^ a b Laboratorul Cavendish .
- ^ Jewett și Serway 2014 , p. 1299 .
- ^ Rutherford's Nucleus Paper din 1911 , pe chemteam.info . Adus pe 9 ianuarie 2020 .
- ^ a b Manners 2000 , p. 28 .
- ^ Abraham Pais,Inward Bound , Oxford University Press, 1986.
- ^ a b Heilbron 2003 , p. 59 .
- ^ Heilbron 2003 .
- ^ Reeves 2008 .
- ^ Tibbetts 2007 , p. 127 .
- ^ Geiger 1908 .
- ^ a b Geiger și Marsden 1909 .
- ^ Geiger 1910 .
Bibliografie
- Rutherford's Nuclear World: The Story of the Discovery of the Nucleus , la aip.org , Institutul American de Fizică. Adus pe 23 octombrie 2014 .
- HyperPhysics , la hyperphysics.phy-astr.gsu.edu , Georgia State University . Adus pe 13 august 2014 .
- Geiger și Marsden , la www-outreach.phy.cam.ac.uk , Laboratorul Cavendish . Adus la 23 iulie 2014 (arhivat din original la 6 octombrie 2014) .
- John Daintith și Derek Gjertsen, Un dicționar de oameni de știință , Oxford University Press , 1999, ISBN 978-0-19-280086-2 .
- Michael Fowler, Rutherford Scattering , în Note de curs pentru Fizică 252 , Universitatea din Virginia . Adus la 23 iulie 2014 .
- Hans Geiger, Despre împrăștierea particulelor α de materie , în Proceedings of the Royal Society of London A , vol. 81, nr. 546, 1908, pp. 174–177, Bibcode : 1908RSPSA..81..174G , DOI : 10.1098 / rspa.1908.0067 .
- Hans Geiger și Ernest Marsden, Despre o reflecție difuză a particulelor α , în Proceedings of the Royal Society of London A , vol. 82, nr. 557, 1909, pp. 495-500, bibcode : 1909RSPSA..82..495G , DOI : 10.1098 / rspa.1909.0054 .
- Hans Geiger, Scattering of the α-Particles by Matter , în Proceedings of the Royal Society of London A , vol. 83, nr. 565, 1910, pp. 492-504, Bibcode : 1910RSPSA..83..492G , DOI : 10.1098 / rspa.1910.0038 .
- Hans Geiger și Ernest Marsden, Legile deflexiei particulelor α prin unghiuri mari ( PDF ), înRevista filozofică , seria 6, vol. 25, nr. 148, 1913, pp. 604-623, DOI : 10.1080 / 14786440408634197 .
- John L. Heilbron, Ernest Rutherford și explozia atomilor , Oxford University Press , 2003, ISBN 978-0-19-512378-4 .
- John W., Jr. Jewett și Raymond A. Serway, Early Models of the Atom , în Physics for Scientists and Engineers with Modern Physics , ediția a IX-a, Brooks / Cole, 2014, p. 1299.
- Joy Manners, Fizica cuantică: o introducere , CRC Press , 2000, ISBN 978-0-7503-0720-8 .
- Hantaro Nagaoka, Cinetica unui sistem de particule care ilustrează linia și spectrul de bandă și fenomenele de radioactivitate , în Revista filozofică , seria 6, vol. 7, nr. 41, 1904, pp. 445–455, DOI : 10.1080 / 14786440409463141 . Adus pe 9 ianuarie 2020 (Arhivat din original la 27 noiembrie 2017) .
- Richard Reeves,A Force of Nature: The Frontier Genius of Ernest Rutherford , WW Norton & Co. , 2008, ISBN 978-0-393-07604-2 .
- Ernest Rutherford, Scattering of α and β Particles by Matter and the Structure of the Atom , în Revista filozofică , seria 6, vol. 21, n. 125, 1911, pp. 669–688, DOI : 10.1080 / 14786440508637080 .
- Ernest Rutherford, Originea razelor β și γ din substanțe radioactive , în Revista filosofică , seria 6, vol. 24, n. 142, 1912, pp. 453–462, DOI : 10.1080 / 14786441008637351 .
- Ernest Rutherford și John Mitchell Nuttal, Scattering de α-Particles by Gases , în Philosophical Magazine , seria 6, vol. 26, n. 154, 1913, pp. 702-712, DOI : 10.1080 / 14786441308635014 .
- Ernest Rutherford, Structura atomului , în revista Philosophical , seria 6, vol. 27, n. 159, 1914, pp. 488–498, DOI : 10.1080 / 14786440308635117 .
- Ernest Rutherford și John A. Ratcliffe, Patruzeci de ani de fizică , în Joseph Needham și Walter Pagel (eds), Background to Modern Science , Cambridge University Press , 1938.
- Ernest Rutherford, Substanțe radioactive și radiațiile lor , Cambridge University Press , 1913.
- Joseph J. Thomson, Despre structura atomului: o investigație a stabilității și perioadelor de oscilare a unui număr de corpusculi dispuși la intervale egale în jurul circumferinței unui cerc; cu Aplicarea rezultatelor la teoria structurii atomice , în Revista filosofică , seria 6, vol. 7, nr. 39, 1904, p. 237, DOI : 10.1080 / 14786440409463107 .
- Gary Tibbetts, How the Great Scientists Reasoned: The Scientific Method in Action , Elsevier , 2007, ISBN 978-0-12-398498-2 .
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre experimentul Rutherford
Wikimedia Commons conține imagini sau alte fișiere despre experimentul Rutherford