Capacitatea de schimb cationic
Capacitatea de schimb de cationi (adesea prescurtată ca CSC ) este cantitatea de cationi schimbabili, exprimată în cmol (+) / kg de sol uscat, pe care un material, numit schimbător , cu proprietăți de adsorbție o poate reține prin schimbul de ioni. Schimbul de ioni reprezintă unul dintre principalele mecanisme prin care solul reține și pune la dispoziția plantelor și microorganismelor elemente precum calciu , magneziu , potasiu , azot amoniacal , prin urmare CSC este un indice al fertilității chimice potențiale a solului .
Adsorbția cationică
Adsorbția sau schimbul de cationi este un proces de suprafață reversibil care se dezvoltă în interfața de separare dintre un material solid, dotat cu proprietăți de schimb și o soluție de săruri.
În sol, schimbătorul este reprezentat de setul de particule solide cu dimensiuni mai mici de 0,1 μm , capabile să se comporte ca coloizi electronegativi hidrofili; aceste particule se încadrează în clasa granulometrică a argilei și sunt reprezentate în mare parte de humus și minerale argiloase propriu-zise ( montmorillonite , vermiculite , ilite etc.). La ridicat pH valori asemenea, hidroxizii de fier ( goethitului , lepidocrocite ) și aluminiu ( gibbsite ) și mineralele argiloase din caolinit se comportă grupa ca coloizi electronegative, dar în conditii normale aceste minerale au o capacitate foarte redusă de schimb de cationi și se comportă ca coloizi electropozitivi. Suprafața totală dezvoltată de coloizi electronegativi se numește generic complex de schimb .
Soluția sărurilor din sol este reprezentată în schimb de apa care ocupă interstițiile solului și de sărurile minerale dizolvate în ea; de aceea se numește soluție circulantă .
Interacțiunea dintre cationi și complexul de schimb este reprezentată de forțe de atracție electrostatice și, ca atare, sunt potențial lipsite de specificitate. În realitate, cationii dizolvați în soluția circulantă sunt hidrați, adică înconjurați de un strat mai mult sau mai puțin gros de molecule de apă; grosimea acestui strat și numărul de sarcini electrice ale cationului asigură că schimbul de cationi are loc ca proces selectiv.
Capacitatea de schimb de cationi a unui schimbător depinde în esență de densitatea sarcinilor electrice negative la suprafață. Originea acestor birouri poate fi urmărită până la una dintre următoarele.
Coloizi organici
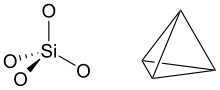
Sarcinile negative provin din disocierea grupelor funcționale acide prin îndepărtarea unui ion hidrogen . Acestea sunt grupările carboxilice (-COOH), în general, și grupările hidroxil (-OH) ale fenolilor :
- -COOH → -COO - + H +
- -OH → -O - + H +
Proprietățile acide ale acestor grupări sunt mai marcate pentru carboxili, în timp ce grupările fenolice participă la formarea sarcinilor negative la suprafață, în special la valori de pH ridicate.
Minerale argiloase
Sarcinile negative prezente pe mineralele argiloase pot avea origini diferite:
- Prezența ionilor hidroxil pe suprafața rețelei (numite grupuri hidroxid de margine ). Elementul structural al filosilicaților (de care aparțin mineralele argiloase) este tetraedrul [SiO 4 ] 4- polimerizat cu un raport Si: O de 1: 2,5. Cu alte cuvinte, trei dintre sarcinile negative sunt neutralizate prin condensarea tetraedrului cu celelalte trei prin împărțirea ionilor de oxigen, în timp ce a patra este neutralizată prin condensarea planului tetraedru cu un plan octaedric de brucită sau gibbsite . Pe laturile planurilor tetraedrice, polimerizarea este întreruptă și în locul oxigenului există grupări hidroxid, care se pot disocia, generând sarcini electrice negative [1] :
- Înlocuirea izomorfă a siliciului cu aluminiu în stratul tetraedric. Înlocuirea unui tetraedru [SiO 4 ] 4- cu un tetraedru [AlO 4 ] 5- generează un exces de sarcină negativă care poate fi neutralizat prin substituții izomorfe inverse în planul octaedric, cu adsorbția sau fixarea cationilor metalici sau cu cloritizarea , adică cu alternanța unui strat 2: 1 cu un strat octaedric electropozitiv. Într-un mediu puternic acid aceste sarcini sunt neutralizate de ioni de hidrogen.
Densitatea sarcinilor electrice negative depinde în esență de doi factori: natura sarcinilor și pH-ul solului. În raport cu natura umpluturilor, densitatea este relativ scăzută dacă provin în principal din întreruperea rețelelor cristaline (de exemplu, kaolinită ) și, în medie, mare dacă provin dintr-un număr mare de substituții izomorfe de siliciu-aluminiu (de exemplu, montmorillonit ), este foarte mare dacă provin din disocierea ionică a grupărilor funcționale organice (de exemplu, humus). Rezultă că CSC este în general mai mare la schimbătoarele organice și mai scăzut la cele minerale și, în contextul coloizilor minerali, mai mare la mineralele argiloase bogate în substituții izomorfe ( vermiculite , montmorillonite) și mai mic la filosilicații primari (Tabelul 1). De asemenea, trebuie remarcat faptul că într-un mediu acid unele minerale argiloase, precum kaolinitele, se pot comporta și ca coloizi electropozitivi datorită proprietăților marcat amfotere ale grupărilor hidroxid și gradului scăzut de substituții izomorfe din rețeaua cristalină.
Dintre schimbătoarele de minerale, un comportament special se găsește în zeoliți , o familie de tectosilicați : aceste minerale au un CSC comparabil cu cel al humusului și derivat din structura particulară și gradul ridicat de substituție izomorfă între siliciu și aluminiu.
| Tab. 1 - Gama valorilor CSC ale unor schimbătoare raportate în literatură | |||||
|---|---|---|---|---|---|
| Schimbător | CSC (meq / 100g) | Sursă | Schimbător | CSC (meq / 100g) | Sursă |
| Humus | 300-500 | [2] | Paligorskit [3] | 66-73 | [4] |
| Zeolit [5] | 200-400 | [6] [7] | Halloysite [3] | 40-50 | [8] |
| Alofani [5] | 100-250 | [8] [9] | Paligorskit [5] | 18-40 | [7] [8] |
| Hectorit [3] | 145-165 | [4] | Illite [5] | 10-40 | [8] |
| Vermiculit [5] | 100-150 | [10] | Clorit [5] | 10-40 | [10] |
| Montmorillonit [5] | 80-150 | [4] [7] [10] | Kaolinită [5] | 0-15 | [4] [10] |
Corelația dintre pH și capacitatea de schimb
Toate celelalte lucruri fiind egale, reacția solului joacă un rol fundamental: coloidii electronegativi ai solului, atât organici, cât și minerali, au proprietăți amfotere și, prin urmare, se comportă ca acizi și baze slabe . În condițiile de pH găsite în majoritatea solurilor, humusul și mineralele argiloase se comportă ca acizi slabi și, prin urmare, ca coloizi electronegativi, în timp ce hidroxizii de fier și aluminiu se comportă ca baze slabe și, prin urmare, ca coloizi electropozitivi:
- Clay-H + Me + OH - → Clay - Me + + H 2 O
- Al-OH + XH → Al-OH 2 + X -
Pe măsură ce pH-ul scade, gradul de disociere a coloidilor electronegativi scade, tindând spre punctul izoelectric , prin urmare densitatea sarcinii electrice negative este semnificativ redusă într-un mediu acid. Rezultă că CSC-ul unui sol sau al unui schimbător crește odată cu creșterea pH-ului (scăderea concentrației ionilor H + schimbă echilibrul spre stânga) și scade odată cu scăderea pH-ului (creșterea concentrației ionilor H + deplasează echilibrul spre dreapta) :
- Argilă - Me + + H + → Argilă-H + Me +
Evaluarea CSC a terenurilor
În sol, prezența particulelor cu proprietăți de schimb constituie doar o parte din fracțiunea granulometrică a argilei, prin urmare valorile CSC găsite sunt mult mai mici. În aceste condiții, CSC este determinat nu numai de natura schimbătorului și de pH, ci și de conținutul de argilă. CSC este în general destul de scăzut în solurile libere , sărac în coloizi și în cele din regiunile tropicale, în general bogat în minerale argiloase cu proprietăți de schimb modeste (kaolinite) și practic lipsit de materie organică. Atinge valori relativ ridicate în solurile argiloase din zonele temperate, mai ales dacă sunt bine dotate în minerale din grupurile vermiculite și montmorillonite. Cele mai mari valori ale capacității de schimb cationic se găsesc în orice caz în soluri bine dotate cu substanță organică, cu niveluri extrem de ridicate în solurile turbărești .
Clasificarea solurilor în conformitate cu CSC este prezentată în tabelul 2. În general, valori relativ ridicate, între 15 și 50 meq / 100g se găsesc în soluri argiloase bine dotate cu coloizi cu capacitate mare de schimb, în timp ce în soluri cu un conținut ridicat de organice substanța poate depăși, de asemenea, 100 meq / 100g. Cu toate acestea, aceste indicații sunt doar orientative, deoarece mult depinde de tipul de coloizi minerali și, mai ales, de reacția solului.
| Tab. 2 - Evaluarea CSC a terenurilor [11] | ||
|---|---|---|
| Evaluare | CSC (meq / 100g) | |
| Scăzut | Mai putin decât 10 | |
| In medie | 10 - 20 | |
| Înalt | peste 20 | |
Determinarea CSC
Determinarea capacității de schimb cationic face parte din procedurile de rutină ale unei analize a solului . Acest parametru, de fapt, vă permite să faceți o evaluare inițială a aportului potențial de nutrienți în sol și oferă baza pentru stabilirea unei tehnici de fertilizare corecte, evitând pe de o parte orice fenomen de deficiență și, pe de altă parte, orice pierderi datorate la leșiere și poluarea în consecință. a acvifere .
Principiul pe care se bazează determinarea constă în capacitatea reziduului de bază al unui electrolit de a elimina bazele de schimb adsorbite. Proba de sol este supusă acțiunii unei soluții care conține o sare specifică; în această fază se adoptă proceduri standard care prevăd, de exemplu, tamponarea pH - ului la o valoare de referință, tratamentul mecanic (agitare, centrifugare). În timpul tratamentului, reziduul de bază al sării, reprezentat de un cation, înlocuiește cationii adsorbiți care trec în soluție. Pe extract, eventual tratat, se efectuează determinări specifice, cum ar fi titrarea volumetrică a unui reactiv rezidual utilizat sau care permite trasarea valorii capacității de schimb prin aplicarea formulelor furnizate de metodă.
Fiecare metodă are erori sistematice care pot denatura interpretarea. De fapt, diferitele metode oferă rezultate diferite, în funcție de următorii factori:
- Extracția îndepărtează cu ușurință bazele de schimb , totuși poate exista o dificultate în îndepărtarea ionilor de aluminiu, rezultând o subestimare a CSC în solurile acide.
- Capacitatea de îndepărtare din complexul de schimb variază în funcție de sarea utilizată.
- Tratamentul duce în general la solubilizarea calcarului , datorită formării de bicarbonat de calciu , Ca (HCO 3 ) 2 , cu supraevaluarea consecventă a CSC în soluri bogate în calcar.
- Determinarea este afectată de influența pH-ului asupra gradului de disociere a grupurilor limită de hidroxid ale filosilicaților și poate duce la o supraestimare a CSC a solurilor acide.
Din motivele expuse mai sus, rezultatul unei analize trebuie să fie întotdeauna însoțit de o indicație a metodei utilizate. În general, pot exista erori în interpretarea rezultatelor în soluri marcat acide (subestimare sau supraestimare) și în cele bogate în calcar (supraestimare), în timp ce în general interpretările făcute asupra rezultatelor obținute din soluri cu o reacție care nu este departe de neutru sunt destul de fiabile, deoarece rata de saturație de bază este destul de mare, iar conținutul de calcar este moderat.
Metodologiile adoptate vizează două abordări diferite:
- Tamponarea probei la un pH de referință: această abordare nu depinde de aciditatea solului, prin urmare poate distorsiona semnificativ rezultatele obținute pe solurile puternic acide și pe cele bogate în kaolinită.
- Tamponarea eșantionului la pH-ul real al solului examinat: această abordare este de fapt o estimare indirectă, deoarece determină CSC pe baza calciului, potasiului și magneziului extras, cu toate acestea poate subestima CSC în cazul unui conținut ridicat de aluminiu schimbabil ( caz tipic în soluri acide). O determinare mai precisă necesită executarea unei analize auxiliare pentru a aplica formule corective care permit să se ajungă la rezultate mai fiabile (capacitate efectivă de schimb).
Cele mai frecvent utilizate metode sunt două.
1. Extracția cu acetat de amoniu (CH3 COONH 4) , cu un sistem tamponat pH 7.
Această metodă a fost dezvoltată de Chapman în 1965 [12] . Este metoda adoptată oficial în Italia [13] și este adoptată și ca metodă oficială în multe alte state; în Statele Unite ale Americii a fost adoptat pe scară largă de zeci de ani.
Avantajele acestei metode rezidă, în esență, în disponibilitatea unei baze de date de referință mari și în ușurința relativă de aplicare: deși este destul de lungă (aproximativ 30 de minute), este bine potrivită pentru a fi efectuată în laboratoare de analiză și oferă o repetabilitate corectă a rezultate., cu o marjă de eroare de 10%. Mai mult, extractul poate fi ulterior utilizat pentru determinarea cantitativă a bazelor de schimb ( Ca , K , Mg și Na schimbabile).
Dezavantajele sunt în esență două: primul este asociat cu o supraestimare a CSC a solurilor foarte acide, al doilea cu faptul că acetat de amoniu aduce în soluție cantități semnificative de calciu extras din fracția de calcar. Utilizarea acestei metode nu este recomandată pe solurile alcaline cu un conținut de calcar mai mare de 50% din cauza marjei considerabile de eroare.
2. Extracția cu clorură de bariu (BaCl 2 · 2H 2 O).
Această metodă, recomandată de Soil Science Society of America, are mai multe variante. Metoda clasică implică extracția cu o soluție tamponată cu pH 8,1 de hidroxid de bariu în trietanolamină [14] . Variantele utilizate în prezent au în vedere extracția cu clorură de bariu în soluție apoasă sau în soluție de trietanolamină cu tampon la pH 8,1. În general, acestea sunt metode destul de laborioase, care necesită utilizarea unor echipamente specifice și utilizarea unui reactiv toxic și foarte poluant (clorură de bariu). Avantajul este că este potrivit pentru utilizarea pe majoritatea solurilor și că are o repetabilitate ridicată. Practic este o metodă mai precisă decât cea precedentă, potrivită pentru determinări care necesită o precizie mai mare, dar mai puțin preferată pentru analizele de rutină. În solurile alcaline, în timp ce extrage calciu din fracția de calcar, oferă o marjă de eroare mai mică decât metoda acetatului de amoniu.
Relațiile dintre CSC și capacitatea de tamponare
Complexul de schimb de sol reprezintă un rezervor de ioni de hidrogen și baze de schimb care interferează cu procesele de acidificare și alcalinizare, având tendința de a le anula. Acest comportament constituie componenta fundamentală a puterii de tamponare a solului , cu alte cuvinte proprietatea variațiilor de pH opuse, neutralizând cauzele acestora.
Prezența ionilor de hidrogen în complexul de schimb face ca solul să se opună agenților de alcalinizare: adăugarea unei baze în soluția de circulație inițiază un echilibru de schimb, cu adsorbția reziduului de bază pe complexul de schimb și eliberarea de ioni de hidrogen. Cu alte cuvinte, în condiții de alcalinizare, complexul de schimb tinde să se comporte ca acidul:
În schimb, prezența bazelor de schimb face ca solul să se opună agenților acidifianți: adăugarea unui acid în soluția circulantă inițiază un echilibru de schimb cu adsorbția ionilor de hidrogen și eliberarea unei baze. Cu alte cuvinte, în condiții de acidificare, complexul de schimb tinde să se comporte ca bazic:
Puterea de tamponare a complexului de schimb este epuizată atunci când disponibilitatea ionilor de hidrogen (împotriva alcalinizării) și a bazelor de schimb (împotriva acidificării) încetează, prin urmare proprietatea este strâns legată de CSC total și de rata de saturație a bazelor : puterea de tamponare atinge cea mai mare expresie a sa în soluri cu capacitate de schimb mare și cu o rată de saturație în baze de ordinul a 50%, condiții care apar în general în soluri puternic argiloase, bogate în alofani , vermiculit , montmorillonit și, mai ales, în soluri bogate în organice materie și cu un pH moderat acid (pH 6-6,5).
În solurile sărace în coloizi, cum ar fi solurile libere și cele bogate în schelet, capacitatea redusă de schimb limitează proprietățile lor tampon. Solurile puternic acide, cu un CSC mai mic și, mai presus de toate, cu o lipsă puternică de baze de schimb, sunt deosebit de susceptibile la acidifiere ulterioară, în timp ce au o putere mare de tamponare împotriva alcalinizării. Dimpotrivă, solurile alcaline, având o rată de saturație bazică apropiată de 100%, prezintă o putere de tamponare considerabilă spre acidificare, dar sunt susceptibile de a crește în continuare pH-ul.
Acest comportament explică și dificultatea de a corecta reacția anormală a unui teren cu o capacitate mare de schimb, întrucât complexul de schimb manifestă o inerție considerabilă față de intervențiile corective.
Relațiile dintre CSC și tehnica agronomică
Din cele spuse anterior, este evident că capacitatea de schimb cationic reprezintă un factor important în fertilitatea solului. Complexul de schimb se comportă ca un volant chimic atunci când rata de saturație de bază nu este de 100%: o fertilizare inițiază un echilibru de schimb cu eliberarea ionilor de hidrogen în soluția circulantă și adsorbția cationului pe complexul de schimb. Același cation va fi protejat de spălare și eliberat treptat în soluția de circulație, punându-l la dispoziția plantelor. Tehnica agronomică trebuie să se adapteze la condițiile reale pentru a exploata potențialul oferit de o capacitate de schimb ridicată sau, invers, pentru a depăși limitele unei capacități de schimb reduse.
Teren cu CSC scăzut
Solurile cu CSC scăzut sunt fundamental sărace în nutrienți. În aceste soluri plantele prezintă o lipsă mai mult sau mai puțin marcată de potasiu, calciu și magneziu. Din motive diferite, dar contingente, solurile cu capacitate redusă de schimb sunt în general sărace și în azot și fosfor : de fapt, o capacitate redusă de schimb este în general însoțită de o cantitate modestă de substanță organică, esențială pentru reținerea azotului sub formă organică [15] și de fosfor, atât sub formă organică, cât și minerală, adsorbit pe coloizi organici și coloizi electropozitivi.
Tehnica agronomică trebuie să se adapteze prin integrarea fertilității reduse cu fertilizarea . Fertilizările abundente pot intensifica pierderile datorate levigării, deoarece solul este incapabil să rețină o cantitate semnificativă de substanțe nutritive. Fertilizarea trebuie, prin urmare, să fie moderată și frecventă dacă se utilizează îngrășăminte minerale. Dimpotrivă, contribuția unor cantități semnificative de material organic, în scopul fertilizării organice (cantități moderate) sau modificării (cantități mari) are un efect pozitiv de amploare, întrucât, pe de o parte, îmbunătățește aprovizionarea cu elemente nutriționale și un altul, odată cu umilirea, crește conținutul de coloid și, în consecință, capacitatea de schimb cationic. Prin urmare, o bună practică agricolă în solurile libere constă în recurgerea la gunoi de grajd sau, alternativ, la adăugarea oricărui îngrășământ organic. Fertilizarea minerală nu este în sine nerecomandată, cu toate acestea trebuie utilizată o administrare moderată și întârziată pentru a evita pierderile datorate levigării care ar avea atât un impact economic, cât și de mediu.
Teren cu CSC ridicat
Solurile cu CSC ridicat sunt potențial bogate în substanțe nutritive, dar evaluarea trebuie să fie în mod necesar legată de rata de saturație de bază, parametru care depinde în esență de pH-ul solului.
Dacă reacția este acidă (pH <5-5,5), chiar și în prezența unui CSC ridicat, aportul de elemente nutriționale este redus, în special cel de calciu. Potasiul și magneziul pot fi prezente în cantități discrete, dar cu o reacție puternic acidă, lipsește și aportul acestor baze. Azotul este prezent în cantități echitabile dacă solul este bine dotat cu substanță organică, în timp ce fosforul ar putea lipsi din motive de imobilizare chimică. În aceste soluri, fertilizarea minerală aduce beneficii considerabile, deoarece complexul de schimb este îmbogățit în baze. Efectul nu este în general de durată dacă cauzele acidității nu sunt eliminate sau limitate pe termen lung. O intervenție corectivă combinată cu o fertilizare de bază poate crește semnificativ fertilitatea acestor soluri. În orice caz, răspunsul la fertilizare este întotdeauna pozitiv, mai ales recurgând la administrații fastuoase.
Dacă reacția este neutră sau moderat acidă (pH 6-7,5) solul prezintă o fertilitate potențială excelentă și oferă cea mai largă alegere. Fertilizarea de bază poate fi necesară dacă se constată o deficiență într-o bază de schimb specifică, în timp ce se recomandă întreținerea pentru a menține niveluri ridicate de fertilitate în timp.
Dacă reacția este moderat alcalină (pH 7,5-8,5) solul va avea o rată de saturație bazică ridicată, aproape de 100%. În aceste condiții, fertilitatea potențială este mare, dar este mascată de fenomene de insolubilizare care pot afecta în special fosforul și diferitele microelemente. De asemenea, pot apărea deficiențe de potasiu datorită antagonismului calciului care apare atât în absorbția radicală, cât și în adsorbția coloidală. În general, aceste soluri necesită precauții speciale care tind să conțină procese de insolubilizare. Fertilizarea trebuie să fie prudentă, în special în ceea ce privește contribuția îngrășămintelor fosfatice, în timp ce alte fenomene de deficiență pot fi confruntate cu utilizarea fertilizării foliare sau cu alte măsuri tehnice (de exemplu, utilizarea portaltoilor rezistenți la calcar pentru viță și totuși ). Fertilizarea cu potasiu poate oferi beneficii considerabile, dar, în general, în aceste soluri este o bună practică să se efectueze intervenții moderate și frecvente, deoarece fertilizările fastuoase nu pot da rezultate. Corecția nu este recomandată deoarece CSC ridicat, rata mare de saturație a bazei și conținutul ridicat de calcar activ maximizează puterea de tamponare spre acidificare.
Dacă reacția este puternic alcalină (pH> 8,5) solul va avea o rată de saturație de bază de 100% și mai ales un procent ridicat de sodiu schimbabil, cu repercusiuni foarte grave atât asupra fertilității chimice, cât și asupra fertilității fizice, până la periclitarea exercițiului agricol în sine. În aceste condiții, CSC ridicat reprezintă un defect real, deoarece îngreunează recuperarea acestui teren, dacă nu complet improbabil.
Exemplu de aplicație
Pentru a înțelege importanța capacității de schimb, poate fi util să se facă o comparație cantitativă între două tipuri diferite de terenuri.
Pentru a reprezenta un context optim, din diverse puncte de vedere, ne putem referi la un sol cu textură medie, bine structurat și cu o dotare argiloasă moderată (20-25%), situat într-un mediu mediteranean și cu o reacție neutră. Solul cu aceste caracteristici poate avea o densitate aparentă de ordinul 1,3 t / m 3 . Presupunând că în fracțiunea argiloasă sunt reprezentate minerale argiloase de tip montmorillonit și că dotarea cu humus se află la limita de suficiență, capacitatea de schimb va avea valori medii sau medii-ridicate. Analiza chimică atestă un CSC de 25 meq / 100g și un grad de saturație de bază de 75%. Alocarea în baze de schimb, menționată la CSC, este împărțită după cum urmează: calciu 60%, magneziu 10%, potasiu 5%.
Pentru a reprezenta un context non-optim, din diferite puncte de vedere, ne putem referi la un sol care are tendințe de nisip, bogat în schelet, cu un nivel scăzut de argilă (mai puțin de 5%), situat într-un mediu mediteranean și cu un acid reacție (pH 5). Solul cu aceste caracteristici poate avea o densitate în vrac de ordinul a 1,5 t / m 3 . Acest sol este în sine sărac în coloizi minerali și, datorită texturii grosiere, este supus unor perioade de secetă și temperaturi ridicate care împing echilibrul materiei organice către mineralizare ; prin urmare, conținutul de humus va fi destul de redus. Analiza chimică atestă un CSC de 4 meq / 100g și un grad de saturație de bază de 30%. Alocarea în baze de schimb, menționată la CSC, se împarte după cum urmează: calciu 5%, magneziu 15%, potasiu 10%.
Prima operațiune de făcut este de a calcula masa solului (M) cu care se raportează datele, luând în considerare o adâncime de 40 cm (p) și suprafața de 1 ha (S). Indicând cu d o densitate în vrac și cu V volumul (în metri cubi), calculul se face prin aplicarea următoarei formule:
Coeficientul 100 se aplică pentru a lega lungimile și suprafețele de unitățile de măsură omogene. Indicând cu A terenul primului exemplu și cu B cel al celui de-al doilea exemplu, va fi:
M A = 40 1,3 100 = 5,200 t / ha
M B = 40 1,5 100 = 6,000 t / ha
Capacitatea totală de schimb (exprimată în grame echivalente la hectar) se obține prin aplicarea următoarei formule
Coeficientul 10 se aplică pentru a raporta mase la unități de măsură omogene (tone la grame) și pentru a converti miliechivalenți în echivalenți. Coeficientul include, de asemenea, expresia care leagă CSC în termeni procentuali. În cele două terenuri va fi:
CSCt A = 25 5200 10 = 1,3 10 6 echiv / ha
CSCt B = 4 · 6000 · 10 = 0,24 · 10 6 echiv / ha
În acest moment este posibil să se calculeze dotările, exprimate în t / ha de oxizi respectivi, de calciu, magneziu și potasiu, prin aplicarea următoarei formule:
- .
În formulă, „x” indică procentul elementului din complexul de schimb, „e” greutatea echivalentă a elementului (20 pentru calciu, 12 pentru magneziu, 39 pentru potasiu), „s” coeficientul de conversie stoichiometric în oxidul respectiv (1,4 pentru calciu, 1,67 pentru magneziu, 1,2 pentru potasiu).
| Tab. 3 - Echipamentul bazelor de schimb în cele două soluri de exemplu (în t / ha) | |||
|---|---|---|---|
| CaO | MgO | K 2 O | |
| Terenul A | 21,84 | 2,60 | 3.04 |
| Terenul B | 0,34 | 0,72 | 1.12 |
Presupunând că grâul este cultivat într-o singură succesiune pe cele două terenuri fără fertilizare, că în primul teren există un randament de 30 q / ha și în al doilea de 10 q / ha, rezervele de calciu s-ar epuiza, respectiv, în 1456 de ani în primul pământ și în 68 de ani în al doilea pământ. Cu un raționament similar, rezervele de potasiu s-ar epuiza în 190 și, respectiv, 55 de ani. Aceste calcule, cu o valoare pur teoretică, se bazează pe presupunerea că producția de 1 chintal de cereale elimină 500 g de oxid de calciu [16] și 533 g de oxid de potasiu [17] .
Notă
- ^ În realitate, proprietatea acidă a grupurilor laterale -OH de argile este foarte slabă datorită proprietății amfoterice marcate a grupurilor de apă și hidroxid. Questi siti si dissociano solo a pH superiore a 7, perciò nei terreni neutri e nei terreni acidi non partecipano alla formazione delle cariche negative.
- ^ Belsito et al. Op. cit. , p. 283.
- ^ a b c Minerale sensu stricto
- ^ a b c d S. Battaglia, L. Leoni; F. Sartori, Determinazione della capacità di scambio cationico delle argille attraverso l'analisi in fluorescenza X di pasticche di polvere ( PDF ), in Atti della Società Toscana Scienze Naturali, Memorie, Serie A , vol. 109, 2004, pp. 103-113 (archiviato dall' url originale il 28 settembre 2007) .
- ^ a b c d e f g h Gruppo sensu lato
- ^ Caratteristiche chimico-fisiche delle zeoliti ( PDF ), su Corso "Addetti delle amministrazioni locali del settore ambientale" , Life Ambiente 2002 Progetto "TreLaghi". URL consultato il 16 agosto 2007 .
- ^ a b c Elio Passaglia, Zeoliti zeolititi e loro applicazioni ( PDF ), su terra.unimo.it , Università di Modena e Reggio Emilia, Dipartimento di Scienze della Terra, 9. URL consultato il 16 agosto 2007 (archiviato dall' url originale il 23 agosto 2007) .
- ^ a b c d Belsito et al. Op. cit. , p. 261.
- ^ Mauro Sbaraglia, Lorenzo Sbaraglia, La capacità di scambio cationico nelle analisi pedologiche ( PDF ), su Giornata di studio: Scelta e interpretazione dei metodi di analisi dei suoli al fine della classificazione pedologica. Firenze, 11 aprile 2007 , Associazione Italiana Pedologi. URL consultato il 16 agosto 2007 (archiviato dall' url originale il 12 marzo 2016) .
- ^ a b c d Belsito, et al., Chimica agraria , p. 343.
- ^ LF Goldberg, E. Arduino, La valutazione della fertilità , in Chimica del suolo , Pàtron, p. 522.
- ^ ( EN ) HD Chapman, Cation-exchange capacity , in Methods of soil analysis - Chemical and microbiological properties. Agronomy 9 , CA Black (ed.), 1965, pp. 891-901.
- ^ Metodo Ufficiale n. XIII.1, Supplemento Ordinario della Gazzetta Ufficiale n. 248 del 21 ottobre 1999.
- ^ ( EN ) A. Mehlich, Use of triethanolamine acetate-barium hydroxide buffer for the determination of some base exchange properties and lime requirement of soil , in Soil Sci. Soc. Am. Proc. , vol. 29, 1938, pp. 374-378.
- ^ La CSC inoltre contribuisce direttamente al trattenimento dell'azoto ammoniacale, in quanto lo ione ammonio si comporta come una base di scambio a tutti gli effetti.
- ^ Giardini. Op. cit. , p. 175.
- ^ Giardini. Op. cit. , p. 451.
Bibliografia
- AA.VV, Chimica del suolo , a cura di Paolo Sequi, Bologna, Pàtron, 1989.
- Luigi Giardini, Agronomia generale , 3ª ed., Bologna, Pàtron, 1986.
- Alda Belsito, et al., Chimica agraria , Bologna, Zanichelli, 1988, ISBN 88-08-00790-1 .
- Andrea Giordano, Pedologia , Torino, UTET, 1999, ISBN 88-02-05393-6 .
- G. Gisotti, Principi di geopedologia , Bologna, Calderini, 1988, ISBN 88-7019-347-0 .
- ( EN ) Soil Survey Division Staff (a cura di), Soil survey manual ( PDF ), Soil Conservation Service. US Department of Agriculture Handbook 18, 1993 (archiviato dall' url originale il 12 ottobre 2007) .
Voci correlate
- Proprietà chimiche del terreno
- Adsorbimento
- Potere assorbente del terreno
- Potere tampone del terreno
- Reazione del terreno
- Tasso di saturazione in basi
- Basi di scambio
Collegamenti esterni
- ( EN ) Donald S. Ross, Recommended Methods for Determining Soil Cation Exchange Capacity , su Soil Analysis Parameters & Methods . URL consultato il 5 settembre 2007 (archiviato dall' url originale l'8 agosto 2007) .
- ( EN ) Cation Exchange Capacity (CEC) ( PDF ) [ collegamento interrotto ] , su cropandsoil.oregonstate.edu , Department of Crop and Soil Science, Oregon State University. URL consultato il 2007-00-05 .


![{\ displaystyle [Colloid] {\ begin {matrix} -H \\ - H \ end {matrix}} + Ca ^ {2 +} + 2OH ^ {-} \ longrightarrow [Colloid] ^ {2-} Ca ^ { 2 +} + 2H_ {2} O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f1d5fa53061a9e10bc648b8b0cc9e7da0b18917c)
![{\ displaystyle [Colloid] ^ {2-} Ca ^ {2 +} + 2H ^ {+} \ longrightarrow [Colloid] {\ begin {matrix} -H \\ - H \ end {matrix}} + Ca ^ { 2+}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/32f649d5889e71a610febc1e983369887b2df952)


