Microscopie cu foi luminoase

Microscopia cu foi de lumină , în limba engleză Light Sheet Fluorescence Microscopy ( LSFM ) sau Microscopia de iluminare selectivă cu plan ( SPIM ), este o tehnică de microscopie cu fluorescență prezentată în 2004 de Jan Huisken în care ramurile de iluminare și colectarea semnalelor aparatului de măsurare sunt ortogonale. unul altuia. [1] Iluminarea este de așa natură încât sursa laserului este focalizată doar pe un plan al probei, obținându-se astfel secționarea optică , care poate fi obținută în moduri diferite, printre care cele mai frecvente implică utilizarea unei lentile cilindrice [2] sau modulatori de lumină spațială . [3] Din acest motiv, tehnica prezentată se caracterizează printr-o viteză de achiziție mai mare comparativ cu tehnicile de scanare punctuală (cum ar fi în microscopia cofocală ) și o cantitate mai mică de energie eliberată probei pe unitate de suprafață, făcându-l astfel un instrument analiză adecvată pentru studiul organismelor vii în dezvoltare pe scări biologice de lungă durată. [4]
Din punct de vedere istoric, această tehnică a fost concepută de Richard Adolf Zsigmondy și Henry Siedentopf în 1902, pentru vizualizarea nanoparticulelor de aur , folosind lumina soarelui ca sursă. Din 1994, LSFM s-a dezvoltat pe baza acestei tehnici, utilizând surse laser și probe biologice fluorescente , mai întâi cu numele de microscopie Orthogonal Plane Fluorescence Optical Sectioning ( OPFOS ) [5] și apoi în 2004 cu numele de Microscopie de iluminare selectivă a planului ( SPIM ). Din 2004, au fost implementate diverse modificări și îmbunătățiri, care au ca scop extinderea câmpului vizual [6] [7] sau accelerarea achiziției. [8]
Cu LSFM, este posibil să se obțină imaginea unui întreg plan al interiorului eșantionului, apoi, prin traducerea acestuia din urmă prin foaia de lumină sau prin deplasarea în sine a foii de lumină, este posibil să se lumineze secvențial fiecare dintre planuri, producând o serie de imagini la diferite adâncimi. Din aceste date, reconstrucția organizării și dinamicii proteinelor sau structurilor de interes poate fi reconstituită prin sisteme de analiză și reconstrucție. [9]
Structura
După cum s-a menționat deja, în sistemele LSFM iluminarea este plasată perpendicular pe partea referitoare la colectarea luminii, astfel încât sistemul să poată fi împărțit în două părți care sunt suprapuse spațial numai în corespondență cu camera care conține proba.
Iluminat
Abordare cu lentile cilindrice
În LSFM, cea mai simplă schemă de iluminare posibilă constă pur și simplu din 3 elemente: o sursă laser, un colimator și un obiectiv cilindric. Foarte des, totuși, sistemele de releu sunt, de asemenea, utilizate pentru a extinde sau îngusta fasciculul, astfel încât acesta să fie extins pe o suprafață predeterminată sau obiectivele microscopului pentru a obține o foaie de lumină și mai îngustă. Este adevărat că obiectivele cilindrice permit menținerea costurilor scăzute, dar este, de asemenea, adevărat că acestea nu sunt corecte pentru efectele de curbură a câmpului și alte aberații și nu garantează o talie a fasciculului mai mică de câțiva microni datorită diafragmei numerice limitate.
Pe baza celor spuse și a legilor privind propagarea fasciculelor Gaussiene, este posibil să se cuantifice dimensiunile pe care fasciculul de iluminat le va avea la punctul de focalizare al opticii utilizate:
,
de fapt, grosimea foii luminoase generate determină capacitatea de secțiune optică a probei și, prin urmare, ca primă aproximare, rezoluția axială a sistemului. Un obiectiv cu o deschidere numerică mai mare va produce o foaie ușoară mai subțire, tăind specimenul mai fin.
Pe de altă parte, totuși, o talie mică a grinzii (adică o foaie foarte îngustă) are ca rezultat un parametru Rayleigh mai scurt și, prin urmare, o suprafață imagistică mai mică. De fapt, acest parametru cuantifică cât de mult fasciculul Gauss poate fi considerat o foaie cu lățime limitată. În special, acest parametru se aplică , obținut prin setarea profilului fasciculului egal cu . De obicei, doriți ca acest parametru să fie egal cu jumătate din secțiunea eșantionului pe care doriți să îl analizați.
Abordare cu lentile reglabile
Odată cu eliberarea progresivă a elementelor optice din ce în ce mai sofisticate și versatile, au fost concepute noi moduri de scanare a foilor luminoase.
Una dintre acestea implică utilizarea unui element optic reglabil, în special a unui obiectiv, capabil să schimbe puterea optică atunci când curentul electric care îl controlează variază. De fapt, deoarece distanța focală a lentilei reglabile variază, punctul de grosime minimă a foii este tradus înainte și înapoi pe planul probei. [1] Dacă această mișcare (de obicei pe scara a sute de microsecunde) se realizează pe o dinamică temporală mai scurtă decât achiziția planului unic de către senzor (de ordinul zecilor de milisecunde), rezultatul va fi semnalul de achiziție excitat pe un singur plan, precum cel dat de o lentilă cilindrică.
Această abordare este evident mai scumpă decât utilizarea lentilelor cilindrice singure, necesită și sincronism perfect între iluminare și detectare, de exemplu prin utilizarea microcontrolerelor ; dar permite obținerea unei foi de dimensiuni mai mari decât în cazul anterior, crescând astfel aria probei analizate.
Abordare cu oglindă galvanometrică
Oglindă galvanometrică pentru generarea foii luminoase
Ca și în cazul anterior, utilizarea altor elemente poate permite iluminarea unui singur plan al probei. În special, o oglindă galvanometrică poate fi cuplată cu, de exemplu, un obiectiv optic. Prima este o oglindă , în general metalică, capabilă să se rotească foarte rapid în jurul uneia sau mai multor axe. Prin traducerea fasciculului laser de intrare, este deci posibil să se deplaseze punctul de focalizare al fasciculului însuși dat doar de obiectivul de iluminare (fără deci prezența unui element cilindric), obținându-se un rezultat similar cu cel raportat mai sus. Încă o dată, costurile mai mari și dificultățile de implementare sunt justificate de o viteză de scanare mai mare, care atinge vârfuri de sute de mm / s [10] și de o corecție pentru eventualele aberații introduse de mișcarea fasciculului.
Oglindă galvanometrică pentru mișcarea foii de lumină
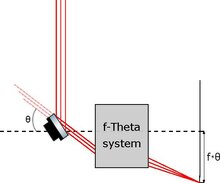
Pe de altă parte, există microscoape cu foi luminoase disponibile comercial, în care schema de iluminare prevede încă utilizarea unei oglinzi galvanometrice, dar pentru a traduce o foaie deja generată de o lentilă cilindrică și nu pentru a genera același lucru ca în paragraful anterior .
Mișcarea foii este posibilă datorită unei configurații schematice particulare numită sistemul f-theta , în care o înclinare unghiulară a oglinzii este direct proporțională (cu o constantă de proporționalitate egală cu focala sistemului) cu deplasarea liniară a punctul de focalizare.
Această schemă de iluminare este utilizată în special pentru studiul interacțiunii unui anumit tip de probă biologică cu un anumit stimul extern. [2] De fapt, prin deplasarea planului iluminat, este posibil să se obțină o reconstrucție volumetrică a obiectului analizei fără a-l deplasa și, prin urmare, fără a induce șocuri mecanice și stimuli suplimentari. Evident, totuși, prin deplasarea planului iluminat, este necesar să-l mențineți focalizat pe senzor, care poate fi obținut în două moduri:
- utilizarea lentilelor electrotunabile în colecție, [8]
- utilizarea unui traducător cu care să mutați obiectivul de colectare, astfel încât distanța dintre planul de intrare țintă și planul iluminat să fie întotdeauna egală cu distanța sa de lucru .
Încă o dată, utilizarea mai multor elemente complică controlul și sincronismul temporal dintre ele.
Abordări hibride
Schemele de iluminare propuse până acum urmează schema generală de iluminare a unui microscop cu foi luminoase, care prevede, atâta timp cât unele elemente sunt schimbate, echivalența cu ramura de colectare. În orice caz, există abordări care modifică această schemă, introducând alte ramuri de iluminare [11] sau modificând unghiul dintre excitație și detectare. [12]
Aceste abordări vizează creșterea raportului semnal / zgomot al imaginilor dobândite și reducerea efectelor de daune optice induse.
Colectie
Indiferent de poziția sa față de ramura de iluminare, colectarea semnalului de fluorescență urmează modelul unui microscop de fluorescență standard.
Acesta constă dintr-un obiectiv optic pentru colectarea fotonilor din probă, un obiectiv tubular , un filtru de fluorescență ( trecere joasă sau trecere de bandă în funcție de fluoroforul prezent în probă) și un senzor.
Fiecare dintre elementele menționate trebuie evaluat în funcție de ceea ce doriți să examinați. În special, parametrii precum mărirea , rezoluția laterală , cantitatea de lumină colectată și câmpul vizual sunt determinate de obiectivul utilizat; calitatea eșantionării și viteza de achiziție a camerei ; respingerea la sursă din banda de filtrare utilizată.
În special, rezoluția laterală a sistemului va fi dată de formula Abbe :
,
unde în numărător există lungimea de undă emisă de eșantion, în numitor deschiderea numerică a obiectivului utilizat.
Pentru a evalua rezoluția axială a sistemului, nu este suficient să se evalueze cea dată de obiectivul în sine, dar este, de asemenea, necesar să se ia în considerare eșantionarea geometrică dată de matricea de pixeli a senzorului, precum și grosimea foii de lumina.
Având în vedere o cameră, un obiectiv și un sistem de lentile tubulare, adâncimea de câmp este:
unde DOF reprezintă adâncimea de câmp, n pentru indicele de refracție al mediului în care este conținută proba, M pentru mărire și e pentru dimensiunea pixelului.
Rezoluția axială a sistemului de iluminare a foii de lumină va fi dată de convoluția sa cu profilul de intensitate al foii de lumină în sine. [13]
Adâncimea extinderii câmpului
Mai ales atunci când se utilizează obiective cu mărire mare și diafragmă numerică, este posibil ca adâncimea de câmp să nu fie suficient de mare pentru a obține o imagine volumetrică a eșantionului fără a o muta. Din acest motiv, au fost concepute tehnici pentru extinderea adâncimii câmpului, fără a afecta rezoluția rezultatului final în comparație cu cazul ne-extins.
Prima tehnică prevede utilizarea elementelor cu proprietăți optice variabile, cum ar fi o lentilă electrotunabilă într-un anumit punct al ramurii de colectare. [8]
Alte tehnici prevăd în schimb introducerea controlată în sistemul de aberații optice, astfel încât să poată, odată ce imaginile probei au fost dobândite, să le desconvolte cu funcția de distribuire a punctelor aberate a sistemului, reconstituind volumul examinat fără a fi dorit efecte. [14]
În concluzie, o altă modalitate de extindere a adâncimii de câmp implică inserarea unui strat de material (lichid sau solid) diferit de lichidul de imagistică pentru caracteristici optice (în special pentru indicele de refracție ), pentru a exploata refracția semnalului de fluorescență și să poată colecta lumina dintr-un con mai lung. [15]
Caracteristicile LSFM
Montarea probei
Dispunerea specială a ramurilor de iluminare și detecție într-un microscop cu foi luminoase înseamnă că proba trebuie poziționată diferit decât în alte tehnici de microscopie optică . De obicei, un microscop LSFM este construit în așa fel încât foaia de lumină să fie perpendiculară pe masa optică, motiv pentru care proba trebuie montată vertical, așa cum se arată în figură. Aceasta nu înseamnă că, datorită varietății mari de probe posibile și a caracteristicilor acestora, fiecare dintre acestea poate avea nevoi diferite. Cele mai comune moduri de remediere sunt următoarele:
- Fixarea probei prin lipici pe un suport, în acest mod este important ca lipiciul să nu fie solubil prin soluția de imersie a probei în sine,
- Probele mai mari (cum ar fi peștele zebră de exemplu), pentru activități de măsurare in vivo , sunt mai întâi sedate și apoi plasate într-o matrice de gel care le permite să respire, dar le menține nemișcate. Pentru problemele de focalizare date de un posibil tub din PVC sau sticlă , este de preferat extrudarea părții de gel cu proba, mai degrabă decât continuarea măsurării în interiorul tubului,
- Culturile celulare pot fi montate pe o lamă de microscop standard, apoi atârnate în camera de probă,
- Alte probe precum Arabidopsis thaliana sunt plasate în geluri precum agaroză sau gelrit . Ulterior, gelul este tăiat, pentru a preveni degradarea calității imaginii datorită împrăștierii și absorbției, atât în ceea ce privește iluminarea, cât și detectarea. [16]
- Probele de lichid pot fi montate în pungi mici de plastic, cu atenție că acesta are un indice de refracție aproape egal cu cel al lichidului utilizat pentru funcționarea corectă a obiectivului, pentru a evita efectul de lentilă dat de un gradient de index. [17]
În schimb, au fost dezvoltate unele LSFM care au exploatat scheme în care foaia de lumină este paralelă cu masa optică. Acestea permit utilizarea tehnicilor de montare standard. [18] [19] [20] [21]
Artefacte cu dungi
Pe măsură ce lumina pătrunde în probă dintr-o parte, orice structură (cum ar fi rădăcinile sau pigmenții din exterior) poate degrada prospectul prin absorbție sau împrăștiere. În special, absorbția dată de zonele cu o creștere semnificativă a indicelui de refracție produce zone de umbră alungite pe partea opusă în raport cu iluminarea. Acest fenomen este o trăsătură distinctivă a microscopiei cu fluorescență a foii ușoare și se numește „ artefacte cu bandă ”
În principiu, există trei modalități de a depăși problema. Primul presupune schimbarea treptată a unghiului de incidență a foii, conform tehnicii cunoscute sub numele de „ pivotare ”. Direcția se schimbă brusc (rată de ~ 1 kHz), peste câteva grade (~ 10 °), astfel încât regiunile altfel ascunse să se lumineze. [3]
În al doilea mod, în loc să avem o singură ramură de iluminare, continuăm cu excitația semnalului din eșantion din ambele părți, astfel încât să eliminăm efectul de umbră dungată. Evident, această abordare dublează doza de lumină pe probă, crescând astfel daunele acesteia. [11]
De asemenea, au fost implementate rutine în care sunt combinate cele două metode de mai sus. [22]
În cele din urmă, există un algoritm numit VSNR ( Variational Stationary Noise Remover ), dezvoltat în Fiji , care ajută la eliminarea unor astfel de artefacte. [23]
Notă
- ^ a b J. Huisken, Secțiune optică Deep Inside Embryos Live by Selective Plane Illumination Microscopy , în Science , vol. 305, n. 5686, 13 august 2004, pp. 1007-1009, DOI : 10.1126 / science.1100035 . Adus la 1 iulie 2019 .
- ^ a b Alex Costa, Alessia Candeo și Luca Fieramonti, Dinamica calciului în celulele radiculare ale Arabidopsis thaliana vizualizate cu microscopie selectivă de iluminare plană , în PLoS ONE , vol. 8, nr. 10, 16 octombrie 2013, pp. e75646, DOI : 10.1371 / journal.pone.0075646 . Adus la 1 iulie 2019 .
- ^ a b Chiara Garbellotto și Jonathan M. Taylor, microscop multifuncțional SLM-light-sheet microscope , în Biomedical Optics Express , vol. 9, nr. 11, 12 octombrie 2018, p. 5419, DOI : 10.1364 / boe.9.005419 . Adus la 1 iulie 2019 .
- ^ (EN) Michael W. Adams, Andrew F. Loftus și Sarah E. Dunn, Current Protocols in Cytometry , John Wiley & Sons, Inc., 5 ianuarie 2015, pp. 12.37.1–12.37.15, DOI : 10.1002 / 0471142956.cy1237s71 , ISBN 978-0-471-14295-9 . Adus la 1 iulie 2019 .
- ^ Jan AN Buytaert, Emilie Descamps și Dominique Adriaens, Familia microscopiei OPFOS: Secționarea optică de înaltă rezoluție a specimenelor biomedicale , în Anatomy Research International , vol. 2012, 3 noiembrie 2012, pp. 1-9, DOI : 10.1155 / 2012/206238 . Adus la 1 iulie 2019 .
- ^ Rory M. Power și Jan Huisken, Adaptable, microscopie cu foaie de lumină cu model de iluminare , în Scientific Reports , vol. 8, nr. 1, 25 iunie 2018, DOI : 10.1038 / s41598-018-28036-2 . Adus la 1 iulie 2019 .
- ^ Sébastien Wolf, Willy Supatto și Georges Debrégeas, Imagistica funcțională a întregului creier cu microscopie cu două fotoni de lumină , în Nature Methods , vol. 12, nr. 5, 29 aprilie 2015, pp. 379-380, DOI : 10.1038 / nmeth.3371 . Adus pe 2 iulie 2019 .
- ^ a b c Florian O. Fahrbach, Fabian F. Voigt și Benjamin Schmid, Microscopie rapidă cu foi de lumină 3D cu lentilă reglabilă , în Optics Express , vol. 21, n. 18, 30 august 2013, p. 21010, DOI : 10.1364 / oe.21.021010 . Adus la 1 iulie 2019 .
- ^ (EN) Johannes Schindelin, Ignacio Arganda-Carreras și Erwin Frize, Fiji: o platformă open-source pentru analiza imaginilor biologice în Nature Methods, vol. 9, nr. 7, 2012-7, pp. 676-682, DOI : 10.1038 / nmeth.2019 . Adus la 1 iulie 2019 .
- ^ Giuseppe Sancataldo, Vladislav Gavryusev și Giuseppe de Vito, Microscopul flexibil cu mai multe fascicule de lumină pentru fluorescență pentru imagistica în direct fără artefacte de stripare , în Frontiers in Neuroanatomy , vol. 13, 8 februarie 2019, DOI : 10.3389 / fnana.2019.00007 . Adus pe 2 iulie 2019 .
- ^ a b Jan Huisken și Didier YR Stainier, Even fluorescence excitation by multidirectional selective plane ilumination microscope (mSPIM) , în Optics Letters , vol. 32, nr. 17, 27 august 2007, p. 2608, DOI : 10.1364 / ol.32.002608 . Adus pe 2 iulie 2019 .
- ^ Berl R Oakley, Facultatea de evaluare 1000 pentru microscopie LITE: excitația înclinată a foii de lumină a organismelor model oferă rezoluție înaltă și fotoblanșare scăzută. , pe F1000 - Evaluare inter pares post-publicare a literaturii biomedicale , 7 mai 2018. Accesat la 2 iulie 2019 .
- ^ MERTZ, JEROME., INTRODUCERE LA MICROSCOPIE OPTICĂ. , CAMBRIDGE UNIV PRESS, 2019, ISBN 1-108-42830-4 ,OCLC 1084422001 . Adus pe 3 iulie 2019 .
- ^ Pantazis Mouroulis, Adâncimea extinderii câmpului cu optică sferică , în Optics Express , vol. 16, n. 17, 11 august 2008, p. 12995, DOI : 10.1364 / oe.16.012995 . Adus pe 4 iulie 2019 .
- ^ Raju Tomer, Matthew Lovett-Barron și Isaac Kauvar, SPED Light Sheet Microscopy: Mapping rapid al structurii și funcției sistemului biologic , în Cell , vol. 163, nr. 7, 2015-12, pp. 1796-1806, DOI : 10.1016 / j.cell.2015.11.061 . Adus pe 3 iulie 2019 .
- ^ Alexis Maizel, Daniel von Wangenheim, Fern n Federici, Jim Haseloff, Ernst HK Stelzer, Imaginea în directă de înaltă rezoluție a creșterii plantelor în condiții luminoase aproape fiziologice folosind microscopia cu fluorescență a foii de lumină , în The Plant Journal , vol. 68, nr. 2, octombrie 2011, pp. 377-385, DOI : 10.1111 / j.1365-313X.2011.04692.x , ISSN 0960-7412 , PMID 21711399 .
- ^ T. Wohland, X. Shi, J. Sankaran și EH Stelzer, sondele cu spectroscopie de corelație a fluorescenței cu iluminare unică (SPIM-FCS) sondează medii tridimensionale neomogene. , în Optics Express , vol. 18, nr. 10, mai 2010, pp. 10627-10641, Bibcode : 2010OExpr..1810627W , DOI : 10.1364 / oe.18.010627 , PMID 20588915 .
- ^ J. Capoulade, M. Wachsmuth, L. Hufnagel și M. Knop, Imagistica cu fluorescență cantitativă a difuziei și interacțiunii proteinelor în celulele vii , în Nature Biotechnology , vol. 29, nr. 9, 2011, pp. 835-839, DOI : 10.1038 / nbt.1928 , PMID 21822256 .
- ^ Terrence F. Holekamp, Diwakar Turaga și Timothy E. Holy, Rapid imagistică fluorescentă tridimensională a activității în populațiile neuronale prin microscopie de iluminare plană cuplată obiectiv , în Neuron , vol. 57, nr. 5, 13 martie 2008, pp. 661-672, DOI : 10.1016 / j.neuron.2008.01.011 , ISSN 0896-6273 , PMID 18341987 .
- ^ Y. Wu, A. Ghitani, R. Christensen, A. Santella, Z. Du, G. Rondeau, Z. Bao, D. Colon-Ramos și H. Shroff,Microscopia de iluminare a planului selectiv inversat (iSPIM) permite celulei cuplate identificarea identității și imagistica neurodezvoltării în Caenorhabditis elegans , în Proceedings of the National Academy of Sciences , vol. 108, nr. 43, 25 octombrie 2011, pp. 17708-17713, Bibcode : 2011PNAS..10817708W , DOI : 10.1073 / pnas.1108494108 , ISSN 0027-8424 , PMC 3203761 , PMID 22006307 .
- ^ Yicong Wu, Peter Wawrzusin, Justin Senseney, Robert S Fischer, Ryan Christensen, Anthony Santella, Andrew G York, Peter W Winter, Clare M Waterman, Zhirong Bao, Daniel A Colón-Ramos, Matthew McAuliffe și Hari Shroff,Spațial izotrop patru -imagistica dimensionala cu microscopie de iluminare plan dual-view , in Nature Biotechnology , vol. 31, n. 11, 2013, pp. 1032-1038, DOI : 10.1038 / nbt . 2713 , ISSN 1087-0156 , PMC 4105320 , PMID 24108093 .
- ^ Jan Huisken și Didier YR Stainier, Even fluorescence excitation by multidirectional selective plane ilumination microscope (mSPIM) , în Optics Letters , vol. 32, nr. 17, 2007, pp. 2608-10, cod bib : 2007OptL ... 32.2608H , DOI : 10.1364 / OL.32.002608 , ISSN 0146-9592 PMID 17767321 . Adus pe 27 octombrie 2012 .
- ^ Jerome Fehrenbach, Pierre Weiss și Corinne Lorenzo, Algoritmi variaționali pentru a elimina zgomotul staționar: aplicații la imagistica microscopică , în IEEE Transactions on Image Processing , vol. 21, n. 10, 2012, pp. 4420-4430, Bibcode : 2012ITIP ... 21.4420F , DOI : 10.1109 / TIP.2012.2206037 , ISSN 1057-7149 , PMID 22752131 .