Transaminare
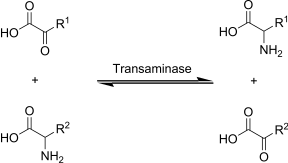
Transaminarea este o reacție chimică în care grupa α-amino a unui aminoacid este transferată la un α-ceto acid (în general α-cetoglutarat ), generând simultan un nou aminoacid și α-ceto acidul corespunzător aminoacidului.
Transaminarea reprezintă prima etapă a catabolismului aminoacizilor, fiind calea metabolică care permite dezaminarea majorității aminoacizilor. Mai mult, reacțiile de transaminare fac posibilă transformarea aminoacizilor esențiali în aminoacizi neesențiali (adică cei pe care organismul este capabil să-i sintetizeze de la zero ).
Din punct de vedere biochimic, reacțiile sunt catalizate de diferite enzime , numite aminotransferaze sau transaminaze , fiecare dintre acestea fiind specific pentru un anumit aminoacid. Deoarece este o reacție de echilibru, produsele reacției depind de disponibilitatea diferiților α-cetoacizi prezenți în interiorul celulei .
Procesul invers al transaminării este dezaminarea . Un exemplu este reacția care implică oxaloacetat și glutamat , principalul colector de grupe amino care derivă din catabolismul aminoacizilor din țesuturile extra-hepatice:
- Glutamat + oxaloacetat ↔ α-cetoglutarat + aspartat
Această reacție este una dintre cele două metode care permite introducerea grupării amino în ciclul ureei .
Mecanism de reacție
Reacția de transaminare are loc datorită prezenței coenzimei care conține o grupare aldehidă , piridoxal-5'-fosfat (PLP) , un derivat al piridoxinei ( vitamina B 6 ). Reacția catalizată de transaminază are loc în două etape. În prima, grupa α-amino a unui aminoacid este transferată către enzimă, producând α-cetoacidul corespunzător și forma amină a coenzimei PLP, numită PMP (pridoxamină-5'-fosfat). În a doua etapă, grupa amino este transferată la cetoacidul acceptor, generând noul aminoacid și restabilind coenzima PLP la forma sa inițială.
Descrierea mecanismului
PLP formează o legătură covalentă cu enzima prin condensarea grupării sale aldehidă cu gruparea ε-amino a unui reziduu de lizină ( Lys ). Baza Schiff formată se numește " aldimină internă " și este situl activ al enzimei, o proprietate datorită conjugării sale cu inelul piridinic . Când intră în situsul activ al enzimei, aminoacidul substrat îl înlocuiește pe Lys în formarea bazei Schiff datorită unei „transimminări”.
Odată ce s-a format „ aldimina externă ”, scăderea unui proton de către un grup de bază al situsului activ (cataliza generală de bază) duce la formarea unei sarcini negative pe carbonul α. Prin urmare, există un intermediar carbanionic stabilizat prin rezonanță: delocalizarea sarcinii negative este posibilă datorită fluxului de electroni printr-un sistem complex de legături duble conjugate, ceea ce duce la neutralizarea sarcinii pozitive prezente în inelul piridinic al PLP. Implicarea azotului piridinic încărcat pozitiv într-o „capcană electronică” este similară cu inelul tiazolic al pirofosfatului tiaminei (TPP) în reacțiile catalizate de piruvat dehidrogenază și transketolază și în cazul bazei Schiff protonate în reacții catalizate de aldolază și transaldolază . Structura limitativă de rezonanță în care sarcina pozitivă din inelul piridinic a fost neutralizată este intermediarul chinonoid , numit astfel datorită poziției legăturilor duble din inel similară cu cea a unei chinone .
După formarea intermediarului chinonoid se poate presupune că această specie continuă în reacție printr-o adăugare electrofilă de proton la dubla legătură C = C. Aceasta determină ruperea dublei legături și formarea concomitentă a unei carbocații pe inelul piridinic, a cărui sarcină este neutralizată grație rearanjării legăturilor duble, care restabilește inelul piridinic cu sarcina pozitivă pe atomul de azot. În acest mod s-a obținut o bază Schiff protonată (ketimină), a cărei hidroliză eliberează un α-cetoacid.
Aminoacidul inițial s-a transformat apoi în a-cetoacid, unul dintre cei doi produși ai reacției de transaminare, în timp ce gruparea sa amino este acum încorporată tranzitoriu în PMP. Secvența reacțiilor reprezintă doar o parte din reacția generală catalizată de transaminaze. Pentru a finaliza reacția, un nou α-ceto acid îl înlocuiește pe cel eliberat și, prin dobândirea grupei amino de piridoxamină-5'-fosfat, este transformat în aminoacidul corespunzător (adică al doilea produs de reacție), prin aceeași secvență de reacții, adică efectuează dimpotrivă, reformând coenzima inițială PLP.
Mecanism alternativ
Un al doilea tip de transaminare este descris ca o substituție nucleofilă a unei amine sau a unui anion amidă pentru o amină sau o sare de amoniu. De exemplu, atașarea unui anion amidă la o amină primară este utilizată pentru a produce amine secundare:
RNH 2 + R'NH - → RR'NH + NH 2 -
În laborator este posibilă prepararea aminelor secundare simetrice utilizând nichel Raney (2RNH 2 → R 2 NH + NH 3 ). În cele din urmă, sărurile cuaternare de amoniu pot fi dezalchilate folosind etanolamină:
R 4 N + + NH 2 CH 2 CH 2 OH → R 3 N + RN + H 2 CH 2 CH 2 OH
Aminonaphtalenele suferă, de asemenea, o reacție de transaminare în timpul catabolismului lor.
Tipuri de aminotransferaze
Reacția de transaminare poate fi catalizată de unele enzime diferite: ele pot fi specifice pentru aminoacizi unici sau pot cataliza reacția pentru grupuri de aminoacizi compuși din unități similare din punct de vedere chimic, așa cum se întâmplă pentru grupul de aminoacizi cu lanț ramificat, care include leucina , izoleucină și valină . Cele mai frecvente tipuri de transaminaze sunt alanina transaminaza (ALT) și aspartatul aminotransaminaza (AST).
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre Transamminare
Wikimedia Commons conține imagini sau alte fișiere despre Transamminare
| Controlul autorității | Tezaur BNCF 41290 |
|---|