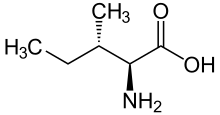
Isoleucina
| Isoleucina | |
|---|---|
| Numele IUPAC | |
| L-izoleucină | |
| Abrevieri | |
| THE Ile | |
| Denumiri alternative | |
| (2S, 3S) -2-amino-3-metilpentanoic acid complementar complementar | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 6 H 13 NO 2 |
| Masa moleculară ( u ) | 131,17 |
| Aspect | solid cristalin alb |
| numar CAS | |
| Numărul EINECS | 200-798-2 |
| PubChem | 6306 |
| DrugBank | DB00167 |
| ZÂMBETE | CCC(C)C(C(=O)O)N |
| Proprietăți fizico-chimice | |
| Constanta de disociere a acidului la 293 K. | pK 1 : 2.32 pK 2 : 9,76 |
| Punctul isoelectric | 6.05 |
| Solubilitate în apă | 32,1 g / l la 293 K. |
| Temperatură de topire | 279 ° C (552 K) cu descompunere |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | −637,8 |
| Informații de siguranță | |
| Fraze H | --- |
| Sfaturi P | --- [1] |
Isoleucina (simbolul Ile sau I ) [2] este un α- aminoacid , molecula sa este chirală . Conține o grupare α-amino (protonată la -NH + 3 în condiții fiziologice), o grupă carboxil (deprotonată la -COO - în condiții fiziologice) și un lanț lateral alifatic, un sec-butil , clasificat ca nepolar și neîncărcat (un pH fiziologic). Prin urmare, în condiții fiziologice se găsește sub forma zwitterionică .
Enantiomerul L este unul dintre cei douăzeci de aminoacizi obișnuiți și se referă la stereoizomerul acid (2 S , 3S) -2-amino-3-metilpentanoic - aceasta este configurația naturală.
Este un aminoacid esențial la om, de fapt organismul nu îl poate sintetiza și, prin urmare, trebuie luat împreună cu dieta. Izoleucina este sintetizată în alte organisme, cum ar fi bacteriile, din piruvat folosind enzime leucine biosintetice [3] . În transcrierea genetică este codificată de codonii AUU, AUC, AUA, care corespund tripletelor de nucleotide ATT, ATC, ATA din ADN .
Prezența acestui aminoacid în compoziția medie a proteinelor organismelor eucariote variază între 3% și 9% [4] , în funcție de regatul taxonomic de origine.
Metabolism
Biosinteza
Fiind un nutrient esențial (nu sintetizat de corpul uman), izoleucina trebuie luată împreună cu dieta, de obicei ca o componentă a proteinelor. În plante și microorganisme este sintetizat în diferite etape, începând de la acidul piruvic și alfa-cetoglutaratul. Enzimele implicate în această biosinteză includ [5] :
- Acetolactat sintază
- Izomeroreductaza acidului hidroxiacetic
- Dihidroxi acid dehidrază [6]
- Valin aminotransferaza
Catabolism
Isoleucina este atât un aminoacid glucogen, cât și un cetogen . După transaminarea cu alfa-cetoglutarat, lanțul lateral alifatic poate fi transformat fie în succinil-coenzimă A și introdus în ciclul acidului citric pentru oxidare, fie transformat în acid oxaloacetic pentru gluconeogeneză (deci glucogenă). De asemenea, poate fi transformat în acetil-coenzimă A și introdus în ciclul acidului citric prin condensare cu acid oxaloacetic pentru a forma citrat . La mamifere, acetil-coenzima A nu poate fi transformată înapoi în carbohidrați, dar poate fi utilizată în sinteza corpurilor cetonice sau a acizilor grași , prin urmare, izoleucina este un aminoacid cetogen [7] .
Incapacitatea de a metaboliza izoleucina, împreună cu alți aminoacizi, este asociată cu boala MSUD care constă în decolorarea urinei pacientului și a mirosului caracteristic al acestora, de unde și numele patologiei. În cazurile severe, boala poate duce la deteriorarea celulelor nervoase și la moarte [8] .
Rezistenta la insulina
Isoleucina, ca și alți aminoacizi cu lanț ramificat , este asociată cu rezistența la insulină : se observă niveluri mai ridicate de izoleucină în sângele șoarecilor, șobolanilor și oamenilor cu diabet [9] . La șoareci, o dietă zilnică lipsită de izoleucină îmbunătățește sensibilitatea la insulină, în timp ce o dietă săptămânală de acest tip scade semnificativ nivelul glicemiei [10] . La șoarecii care suferă de obezitate indusă de dietă și rezistentă la insulină, o dietă cu niveluri scăzute de izoleucină și alți aminoacizi cu lanț ramificat duce la o reducere a adipozității și la o îmbunătățire a sensibilității la insulină [11] .
Cerință zilnică
Organizația Mondială a Sănătății a recomandat necesitatea zilnică pentru acest aminoacid esențial de 20 mg / kg greutate corporală [12] . De exemplu, valoarea recomandată pentru o persoană de 70 kg este de 1400 mg.
Surse nutritive
Deși acest aminoacid nu este biosintetizat de animale, este prezent și în cantități mari în alimentele de origine animală. Alimentele cu cel mai mare conținut de izoleucină includ: ouă, proteine din soia, alge marine, curcan, pui, miel, brânză și pește [13] .
Stereoizomerii
Isoleucina face parte, împreună cu treonina , din familia restrânsă de α-aminoacizi naturali care conțin doi centri stereogenici. Există patru stereoizomeri posibili și au configurație absolută respectiv: (2 S , 3S), (2 R , 3R), (2 S , 3R) și (2 R , 3S). Când vorbim despre L-treonină ne referim la stereoizomerul (2 S , 3 R ), cel mai reprezentat în natură.
| Nume | L-izoleucină | D-izoleucină | L- la- izoleucină | D- la- izoleucină |
|---|---|---|---|---|
| Structura | ||||
| Numele IUPAC | Acid (2S, 3S) -2-amino-3-metilpentanoic ( S ) -izoleucina | Acid (2R, 3R) -2-amino-3-metilpentanoic ( R ) -izoleucina | Acid (2S, 3R) -2-amino-3-metilpentanoic | Acid (2R, 3S) -2-amino-3-metilpentanoic |
| numar CAS | 73-32-5 | 319-78-8 | 1509-34-8 | 1509-35-9 |
| PubChem CID NCBI | 6306 | 76551 | 99288 | 94206 |
| Punct de fuziune | Descompunere: 284 ° C IFA-GESTIS |
Sinteză
Izoleucina poate fi sintetizată într-un proces cu mai multe etape începând de la 2-bromobutan și dietilmalonat [14] . Izoleucina sintetică a fost raportată pentru prima dată în 1905 de către chimistul francez Louis Bouveault [15] .
Chimistul german Felix Ehrlich a descoperit izoleucina în melasa sfeclei în 1903 [16] .
Notă
- ^ Fișă informativă despre izoleucină pe IFA-GESTIS
- ^ Nomenclatură și simbolism pentru aminoacizi și peptide , pe chem.qmul.ac.uk , IUPAC-IUB Joint Commission on Biochemical Nomenclature, 1983. Accesat la 5 martie 2018 (arhivat din original la 9 octombrie 2008) .
- ^ Kisumi M, Komatsubara S, Chibata I, Pathway for isoleucine form form piruvate by leucine biosynthetic enzymes in leucine-accumulating isoleucine revertants of Serratia marcescens , in Journal of Biochemistry , vol. 82, nr. 1, iulie 1977, pp. 95-103, PMID 142769 .
- ^ (EN) Gaur, Rajneesh Kumar., „Distribuția frecvenței aminoacizilor printre proteinele eucariote.” , în Jurnalul IIOAB , 5: Numărul 2, 2014, pp. 6-11.
- ^ (EN) David L. Nelson și Michael M. Cox,Principiile Lehninger de biochimie , ediția a treia, Worth Publishing, 2000, ISBN 978-1-57259-931-4 .
- ^ (EN) JW Myers, Dihidroxi acid dehidrază: o enzimă implicată în biosinteza izoleucinei și valinei , în The Journal of Biological Chemistry, vol. 236, nr. 5, 1961, pp. 1414-1418.
- ^ Jeffrey T. Cole, Capitolul 2: Metabolismul BCAA ( PDF ), în Rajkumar Rajendram, Victor R. Preedy și Vinood B. Patel (eds), Aminoacizi cu lanț ramificat în nutriție clinică , vol. 1, ISBN 978-1-4939-1923-9 .
- ^ Boala de urină cu sirop de arțar (MSUD) , la learn.genetics.utah.edu . Adus la 8 decembrie 2015 (arhivat din original la 10 decembrie 2015) .
- ^ Lynch CJ, Adams SH,aminoacizi cu lanț ramificat în semnalizarea metabolică și rezistența la insulină , în Nature Reviews. Endocrinologie , vol. 10, nr. 12, decembrie 2014, pp. 723–36, DOI : 10.1038 / nrendo.2014.171 , PMC 4424797 , PMID 25287287 .
- ^ Xiao F, Yu J, Guo Y, Deng J, Li K, Du Y, Chen S, Zhu J, Sheng H, Guo F, Efectele privării individuale a aminoacizilor cu lanț ramificat asupra sensibilității la insulină și a metabolismului glucozei la șoareci , în Metabolism , vol. 63, nr. 6, iunie 2014, pp. 841-50, DOI : 10.1016 / j.metabol.2014.03.006 , PMID 24684822 .
- ^ Cummings NE, Williams EM, Kasza I, Konon EN, Schaid MD, Schmidt BA, Poudel C, Sherman DS, Yu D, Arriola Apelo SI, Cottrell SE, Geiger G, Barnes ME, Wisinski JA, Fenske RJ, Matkowskyj KA, Kimple ME, Alexander CM, Merrins MJ, Lamming DW, Restabilirea sănătății metabolice prin scăderea consumului de aminoacizi cu lanț ramificat , în The Journal of Physiology , decembrie 2017, DOI : 10.1113 / JP275075 , PMID 29266268 .
- ^ (RO) CERINȚELE FAO / OMS / UNU, PROTEINE ȘI AMINOACIDI ÎN NUTRIȚIA UMANĂ ( PDF ), whqlibdoc.who.int , WHO Press, 2007. , pagina 150
- ^ Alimente cu cea mai mare cantitate de izoleucină , în datele de auto-nutriție , Condé Nast.
"Lista este în ordinea de la cea mai mare la cea mai mică din 200 de calorii, servirea alimentelor, nu volumul sau greutatea." . - ^ (EN) dl-izoleucină , în Sinteze organice, vol. 21, n. 60, 1941, DOI : 10.15227 / orgsyn.021.0060 .
- ^ ( FR ) L. Bouveault, Action du sodium sur les éthers des acides monobasiques à fonction simple de la série grasse , în Comptes Rendus Chimie , vol. 140, 1905, pp. 1593-1595.
- ^ Felix Ehrlich, Über das natürliche Isomere des Leucins , în Berichte der deutschen chemischen Gesellschaft , vol. 40, nr. 2, -, pp. 2538-2562, DOI : 10.1002 / cber . 190704002181 .
Bibliografie
- ( EN ) David L. Nelson și Michael M. Cox,Principiile Lehninger de biochimie , ediția a treia, Worth Publishing, 2000, ISBN 978-1-57259-931-4 .
Elemente conexe
Alte proiecte
-
 Wikționarul conține dicționarul lema « izoleucină »
Wikționarul conține dicționarul lema « izoleucină » -
 Wikimedia Commons conține imagini sau alte fișiere pe izoleucină
Wikimedia Commons conține imagini sau alte fișiere pe izoleucină
linkuri externe
- ( EN ) Isoleucine , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.