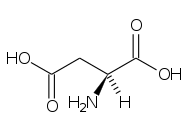
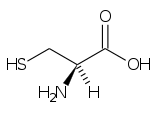
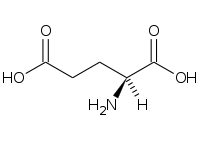
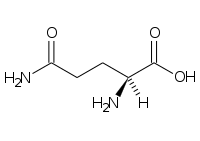
Amino acid
În chimie , aminoacizii sunt molecule organice care transportă atât grupa amino funcțională ( ), atât cea carboxilică ( ) . Cuvântul aminoacid derivă din această proprietate. Deoarece au o grupă acidă (cea carboxilică) și o grupă bazică (cea amino) în același timp, ele se numesc molecule amfotere . În funcție de valoarea pH - ului mediului chimic în care se găsește molecula, cele două grupuri pot fi neutre sau ionizate. În condiții fiziologice, aminoacizii au grupul acid încărcat negativ ( ) și cel de bază încărcat pozitiv ( ): dacă aminoacidul nu are alte sarcini, atunci va lua numele de zwitterion , deoarece sarcina sa globală va fi neutră, dacă la nivel global este încărcată pozitiv va fi un cation , altfel un anion .
În biochimie, termenul de aminoacizi se referă cel mai adesea la L-α-aminoacizi , adică cei a căror grupare amino și grupare carboxilică sunt legați de același atom de carbon , numit carbon α, în configurație L. L-α-aminoacizii sunt în general unitățile constitutive ale proteinelor și din acest motiv sunt definiți ca proteinogeni ; în funcție de tip (sunt 22) [1] [2] , numărul și ordinea secvenței în care sunt legați diferiții aminoacizi, este posibil să se obțină un număr enorm de proteine. Legătura covalentă care unește grupul a unui aminoacid cu asta unui alt aminoacid este denumită o legătură peptidică sau articulație peptidică . Lanțurile peptidice sunt indicate prin termenul de polipeptide și pot conține un număr foarte mare (sute sau mii) de unități; dacă numărul de unități este limitat la mai puțin de zece, se folosește termenul oligopeptide . Lanțurile polipeptidice simple alcătuiesc structura primară a proteinelor .
Aminoacizii neproteinogenici, pe de altă parte, sunt toți ceilalți aminoacizi care nu sunt implicați în sinteza proteinelor. Numeric sunt mii.
Istorie
Primii aminoacizi au fost descoperiți la începutul secolului al XIX-lea. În 1806, chimiștii francezi Louis-Nicolas Vauquelin și Pierre Jean Robiquet au izolat un compus din sparanghel care a fost numit ulterior asparagină, primul aminoacid descoperit. Cistina a fost descoperită în 1810, deși monomerul său, cisteina, a rămas necunoscut până în 1884. Glicina și leucina au fost descoperite în 1820. Ultimul dintre cei 20 de aminoacizi comuni descoperiți a fost treonina în 1935 de William Cumming Rose, care a determinat și aminoacizii esențiali. și a stabilit necesarul zilnic minim de toți aminoacizii pentru o creștere optimă.
Unitatea categoriei chimice a fost recunoscută în 1865 de Wurtz, care nu i-a dat un anumit nume. Utilizarea termenului „aminoacid” în limba engleză datează din 1898, în timp ce termenul german Aminosäure a fost folosit mai devreme. S-a constatat că proteinele pot produce aminoacizi după digestia enzimatică sau hidroliza acidă. În 1902, Emil Fischer și Franz Hofmeister au propus în mod independent că proteinele au fost formate din mulți aminoacizi, prin care se formează legături între grupul amino al unui aminoacid și grupul carboxil al altuia, rezultând o structură liniară pe care Fischer a numit-o „peptidă”. .
Generalitate
Aminoacizii sunt, printre altele, elemente constitutive (monomeri) ale proteinelor [3] .
Prin eliminarea unei molecule de apă (reacție de condensare cu eliminare), grupa amino a unui aminoacid se poate lega de grupul carboxil al altuia
H 2 N-CH-COOH + H 2 N-CH-COOH → H 2 N-CH-CO - NH-CH-COOH + H 2 O
| | | |
RR „RR”
Legătura covalentă care unește cei doi aminoacizi, evidențiată în roșu, ia și denumirea în biochimie de „ legătură peptidică ” sau „articulație peptidică”. Observați cum unirea a doi sau mai mulți aminoacizi lasă la cele două capete ale lanțului alte două grupuri libere, care pot reacționa în continuare prin legarea la alți aminoacizi (reacțiile de acest fel se încadrează în clasa mai generală a polimerizărilor prin condensare ). Un lanț de mai mulți aminoacizi legați prin legături peptidice ia denumirea generică de polipeptidă sau oligopeptidă dacă numărul de aminoacizi implicați este limitat; una sau mai multe polipeptide, uneori însoțite de alte structuri auxiliare sau ioni numiți cofactori sau grupări protetice , alcătuiesc o proteină .
Aminoacizii care apar în proteinele tuturor organismelor vii sunt 20 (deși dovezile recente sugerează că acest număr ar putea crește la 23, vezi mai jos) și se află sub control genetic, în sensul că informațiile despre tipul și localizarea unui aminoacid într-o proteină este codificată în ADN . Uneori, în proteine apar și alți aminoacizi mai rar, denumiți ocazionali care sunt produși prin modificări chimice în urma biosintezei proteinei, care are loc pe ribozom .
Până în prezent au fost descoperiți în natură peste 500 de aminoacizi diferiți care nu fac parte din proteine și joacă roluri biologice diferite. Unele au fost chiar găsite în meteoriți, în special în cele de tip carbonic . În acea cădere pe Murchinson, la 28 septembrie 1969, au fost identificate 74 de tipuri diferite, dintre care 8 sunt prezente în proteine [4] . Plantele și bacteriile sunt capabile să biosintezeze aminoacizi particulari, care pot fi găsiți, de exemplu, în antibiotice peptidice, cum ar fi nisina și alameticina . Lantionina este o sulfură dimerică a alaninei care se găsește împreună cu aminoacizii nesaturați în lantibiotice sau antibiotice peptidice de origine bacteriană. Acidul 1-aminociclopropan-1-carboxilic (ACC) este un aminoacid ciclic simplu disubstituit care acționează ca intermediar în sinteza etilenei , care este un hormon pentru organismele plantelor.
Pe lângă cei implicați în biosinteza proteinelor, există aminoacizi care îndeplinesc funcții biologice importante precum glicina , acidul γ-aminobutiric (GABA, un aminoacid γ) și acidul glutamic (trei neurotransmițători), carnitina (implicată în transport lipidelor din interiorul celulei ), ornitină , citrulină , homocisteină , hidroxiprolină , hidroxilizină și sarcozină .
Dintre cei douăzeci de aminoacizi proteici, unii sunt denumiți „esențiali” [5] . Un aminoacid este definit ca esențial dacă structurile (enzime, proteine sintetice) necesare pentru a-l biosinteza nu sunt prezente în interiorul organismului; de aceea este necesar ca acest aminoacid să fie introdus odată cu dieta. Aminoacizii esențiali sunt lizina , leucina , izoleucina , metionina , fenilalanina , treonina , triptofanul , valina și histidina . În ceea ce privește histidina, este important să se precizeze esențialitatea acesteia: histidina este un aminoacid esențial pe tot parcursul vieții, dar la vârsta adultă cerința nu este foarte relevantă, deoarece organismul este capabil să o stocheze într-un mod deosebit de eficient, reducând cerere. Pe de altă parte, la copii și femei însărcinate, cererea de histidină este mult mai mare, deoarece acest mecanism nu s-a dezvoltat încă.
Există, de asemenea, aminoacizi esențiali condiționali, adică trebuie luați cu dieta numai în anumite perioade ale vieții sau din cauza unor patologii. Arginina face parte din acest grup (este sintetizată de organism ca un derivat al glutamatului produs în ciclul Krebs , dar la femeile gravide și copii producția sa nu este suficientă pentru a acoperi nevoile organismului, deci trebuie luată împreună cu dieta ), tirozina (se produce pornind de la aminoacidul esențial fenilalanină, de aceea este necesar să o luați pe aceasta din urmă cu dieta pentru a o sintetiza; în plus, cazurile de fenilcetonurie nu sunt neobișnuite, o patologie care descrie incapacitatea organismului de a metaboliza fenilalanina, care, prin urmare, nu se transformă în tirozină și se acumulează provocând daune grave organismului) și cisteina (pentru sinteza sa, derivată din glicoliză, este necesară contribuția metioninei , un alt aminoacid esențial, deoarece face posibilă prezența grupul sulfhidril al cisteinei). În cele din urmă, trebuie remarcat faptul că conceptul de esențialitate variază în funcție de organisme [6] [7] .
Doi aminoacizi, numiți ocazionali , merită o notă specială: selenocisteina , corespunzătoare unui codon UGA care este în mod normal un codon de întrerupere [8] și pirolizină , prezentă în enzimele unor bacterii metanogene implicate în procesul de generare a metanului , corespunzătoare unui Codon UAG [9] . Descoperirea primei, în 1986 , a fost interpretată de comunitatea științifică ca un fenomen marginal și restrâns. Cu toate acestea, după descoperirea celui de-al doilea aminoacid suplimentar în 2004 , comunitatea științifică internațională își revizuiește poziția și a început vânătoarea de alți aminoacizi suplimentari .
Structura generică a aminoacizilor
Fiecare aminoacid are o grupă laterală specifică (numită și grupa R ). În funcție de proprietățile chimice ale acestui grup, un aminoacid este clasificat ca acid , bazic , hidrofil (sau polar ) și hidrofob (sau apolar ).
Mărimea diferitelor grupuri R care ies din lanțul polipeptidic, afinitatea reciprocă dintre grupările polare și apolare, atracția dintre grupările bazice și acide sunt câteva dintre forțele care contribuie la modelarea conformației proteinei în spațiu (structura terțiară) , o conformație de care depinde în esență activitatea biologică a proteinei.
Datorită basicității grupării amino și a acidității celei carboxilice, aminoacizii izolați apar sub formă de zwitterions , adică molecule care poartă simultan cele două sarcini opuse, menținând neutralitatea.
H.
|
H3N + - C - COO -
|
R.
Atracția dintre sarcini opuse între mai multe zwitterions explică în plus de ce aminoacizii izolați sunt pulberi cristaline, spre deosebire de amine și acizi carboxilici cu greutate moleculară similară.
Proprietățile fizice - punctul de topire, solubilitatea, momentul dipolar ridicat - sunt tocmai cele așteptate pentru o sare, pentru o structură ionică dipolară de tip I "aminoacizi-ioni dipolari".
- aminoacizii sunt solide cristaline nevolatile, care se topesc cu descompunere la temperaturi foarte ridicate, spre deosebire de amine și acizi carboxilici.
- sunt insolubili în solvenți nepolari, cum ar fi eter de petrol, benzen sau eter; pe de altă parte, sunt destul de solubili în apă.
- soluțiile lor apoase se comportă ca soluții de substanțe cu un moment dipolar ridicat.
Izomerism
Cu excepția glicinei , pentru care R este un atom de hidrogen , aminoacizii sunt molecule chirale , dintre care există câte doi enantiomeri .
Așa cum se întâmplă în mod convențional pentru moleculele de interes biochimic, enantiomerii aminoacizilor sunt marcați cu literele D sau L, în funcție de substituenții legați de atomul de carbon asimetric au un aranjament similar cu cel al L - gliceraldehidă sau al D- gliceraldehidei.
Marea majoritate a proteinelor sintetizate de organismele vii este formată din aminoacizi din seria L , corespunzător configurației absolute S, cu excepția cisteinei care are configurația absolută R. De fapt, conform Cahn-Ingold-Prelog regulile , grupul R are o prioritate mai mică decât cea a grupului COOH, cu excepția cisteinei în care există un atom de sulf.
Unii D aminoacizi au fost găsiți în proteinele produse de organismele care trăiesc în marea adâncă [ necesită citare ] , se găsesc abundent în pereții celulari ai majorității bacteriilor și pot juca un rol de neurotransmițători în creier [10] . D aminoacizii sunt prezenți și în otrăvirea unor animale, cum ar fi moluștele (conurile).
Aminoacizi obișnuiți
În natură, cunoaștem în mod clasic 20 de aminoacizi proteinogeni ; mai recent au fost adăugate alte două (1986, 2004): selenocisteina (SEC), considerată marginală până la descoperirea unui alt aminoacid, 22 °, numit pirolizină (prezent și în unele arhee ). [1] [2] Unii autori admit, de asemenea, un al 23-lea aminoacid proteinogen, N- formilmetionina , un derivat al metioninei , care inițiază sinteza proteinelor unor bacterii. [11] [12]
Corpul nostru este capabil să sintetizeze unii dintre aminoacizii necesari construirii proteinelor, dar nu este capabil să construiască alții, care sunt, prin urmare, definiți ca „ esențiali ” și trebuie introduși împreună cu alimentele.
Structuri
Acestea sunt structurile celor 20 de L-aminoacizi obișnuiți, la care trebuie adăugați cei trei codificați de codoni stop , în condiții speciale și numai la unele specii: pirolizină , selenocisteină și N- formilmetionină , care aduc numărul total la 23.
Atomul de hidrogen legat de atomul de carbon stereogen se află sub planul de citire, grupa amino iese din planul de citire spre observator (cu excepția prolinei, în care grupul iese spre observatorul carboxilic). Grupul R distinct pentru fiecare aminoacid apare în stânga grupului amino.
Proprietăți chimice
Cei 20 de aminoacizi standard pot fi împărțiți în grupuri în funcție de sarcina și polaritatea lanțurilor lor laterale:
- Lanțuri laterale nepolare neutre : alanină , fenilalanină , glicină , izoleucină , leucină , metionină , prolină , triptofan , valină
- Lanțuri laterale polare neutre : asparagină , glutamină , serină , treonină , cisteină , tirozină
- Lanțuri laterale încărcate cu acid : aspartat , glutamat
- Lanțuri laterale încărcate de bază : arginină , histidină , lizină
Aminoacizii standard au în comun proprietăți chimice:
- toți sunt α-aminoacizi (adică, grupa amino și grupa carboxil sunt legate de același atom de carbon)
- la pH fiziologice sunt sub formă de zwitterions [13] [ citare ]
- sunt molecule chirale (cu excepția glicinei , care nu are stereocentri ) și aminoacizii de origine naturală au stereocentrul în configurație S
| simbol | Nume | tip de R | index hidrofob [14] | P.M | pI | pK 1 | pK 2 | pK r | frecvență în proteine [15] | Notă | |
| LA | Aripa | Alanină | hidrofob | 1.8 | 89.09404 | 6.11 | 2.35 | 9,87 | 8,76 | ||
| C. | Cys | Cisteina | hidrofil | 2.5 | 121,15404 | 5.05 | 1,92 | 10.70 | 8.37 | 1,38 | Într-un mediu oxidant , două molecule de cisteină se unesc printr-o punte disulfură -SS - dând naștere unui dimer, cistină , care este în schimb nepolar hidrofob; acest fenomen din proteine permite unirea punctelor îndepărtate ale unui lanț polipeptidic sau ale diferitelor lanțuri polipeptidice. |
| D. | Asp | Acid aspartic | acid | -3,5 | 133.10384 | 2,85 | 1,99 | 9,90 | 3,90 | 5.49 | |
| ȘI | Glu | Acid glutamic | acid | -3,5 | 147.13074 | 3.15 | 2.10 | 9.47 | 4.07 | 6.32 | |
| F. | Phe | Fenilalanină | hidrofob aromat | 2.8 | 165.19184 | 5.49 | 2.20 | 9.31 | 3,87 | ||
| G. | Gly | Glicină | hidrofob | -0,4 | 75.06714 | 6.06 | 2.35 | 9,78 | 7.03 | Având doi atomi de hidrogen legați de carbonul α, glicina nu este chirală . | |
| H. | A lui | Histidină | de bază | -3.2 | 155.15634 | 7,60 | 1,80 | 9.33 | 6.04 | 2.26 | |
| THE | Ile | Isoleucina | hidrofob | 4.5 | 131.17464 | 6.05 | 2.32 | 9,76 | 5.49 | Atât carbonul α cât și β sunt stereogene | |
| K. | Lys | Lizină | de bază | -3,9 | 146.18934 | 9.60 | 2.16 | 9.06 | 10.54 | 5.19 | |
| L | Leu | Leucina | hidrofob | 3.8 | 131.17464 | 6.01 | 2.33 | 9.74 | 9,68 | ||
| M. | Întâlnit | Metionină | hidrofob | 1.9 | 149.20784 | 5,74 | 2.13 | 9.28 | 2.32 | Este întotdeauna primul aminoacid cu care începe sinteza proteinelor ; uneori este îndepărtată după ce proteina a fost asamblată. | |
| Nu. | Asn | Asparagine | hidrofil | -3,5 | 132.11904 | 5.41 | 2.14 | 8,72 | 3,93 | ||
| P. | Pro | Proline | hidrofob | -1,6 | 115.13194 | 6.30 | 1,95 | 10.64 | 5.02 | Deoarece legătura Cα-N nu se poate roti, acest aminoacid interferează cu plierea structurilor elicoidale α sau β . | |
| Î | Gln | Glutamina | hidrofil | -3,5 | 146.14594 | 5,65 | 2.17 | 9.13 | 3,90 | ||
| R. | Arg | Arginina | de bază | -4,5 | 174.20274 | 10,76 | 1,82 | 8,99 | 12.48 | 5,78 | |
| S. | Ser | Serine | hidrofil | -0,8 | 105.09344 | 5,68 | 2.19 | 9.21 | 7.14 | ||
| T. | Thr | Treonina | hidrofil | -0,7 | 119.12034 | 5,60 | 2.09 | 9.10 | 5.53 | Atât carbonul α cât și β sunt stereogene | |
| V. | Val | Valina | hidrofob | 4.2 | 117.14784 | 6.00 | 2.39 | 9.74 | 6,73 | ||
| W | Trp | Triptofan | hidrofob aromat | -0,9 | 204.22844 | 5,89 | 2,46 | 9.41 | 1,25 | ||
| Da | Tyr | Tirozină | hidrofob aromat | -1,3 | 181.19124 | 5,64 | 2.20 | 9.21 | 10.46 | 2,91 | |
Simbolul convențional dintr-o literă pentru un aminoacid generic este X ; simbolul cu trei litere asx indică indiferent atât asparagina, cât și acidul aspartic .
Reacție de protonare / deprotonare
Din valoarea pKa a grupurilor amino și carboxi și a unor grupuri laterale și, prin urmare, din poziția echilibrelor relative acid / bază, este posibil să se obțină informații despre sarcina parțială în diferitele valori ale pH-ului; într-o soluție neutră: [16]
- Gruparea carboxil este de preferat încărcată negativ.
- Gruparea amino este preferabil încărcată pozitiv.
- Grupul R de aspartat și glutamat este, de preferință, încărcat negativ.
- Grupul R de lizină și arginină este la pH 7, de preferat încărcat pozitiv.
- Grupul R al tirozinei este în cea mai mare parte neutru.
- Grupul R al histidinei are o probabilitate de 10% de a fi încărcat pozitiv la pH 7, dar probabilitatea crește până la 50% în soluțiile la pH 6. Histidina este, prin urmare, foarte sensibilă la modificările pH-ului în domeniul fiziologic.
Sinteza aminoacizilor
Aminoacizii pot fi sintetizați prin 3 moduri:
- Aminarea acizilor α-bromocarboxilici din halogenarea Hell-Volhard-Zelinsky anterioară;
- sinteza Gabriel modificată;
- Sinteza streckerului .
O metodă importantă de separare a aminoacizilor (și proteinelor) este electroforeza , care se bazează pe diferitele rate și direcții de migrare - spre anod sau catod - în prezența unui câmp electric cu pH controlat.
Notă
- ^ a b Michael Rother și Joseph A. Krzycki , Selenocisteină, pirolizină și metabolismul energetic unic al arheelor metanogene , în Archaea (Vancouver, BC) , vol. 2010, 17 august 2010, DOI : 10.1155 / 2010/453642 . Adus la 16 aprilie 2018 .
- ^ a b TC Stadtman, Selenium biochimie , în Știință (New York, NY) , vol. 183, nr. 4128, 8 martie 1974, pp. 915–922. Adus la 16 aprilie 2018 .
- ^ Berg, Jeremy M. (Jeremy Mark), 1958- și Stryer, Lubert., Biochimie , ediția a VII-a, WH Freeman, 2012, ISBN 978-1-4292-2936-4 ,OCLC 758952268 .
- ^ Bill Bryson, A Brief History of (Almost) Everything , TEA, 2011, p. 321, ISBN 978-88-502-1549-2 .
- ^ VR Young, Cerințe de aminoacizi pentru adulți: cazul unei revizuiri majore în recomandările actuale , în The Journal of Nutrition , vol. 124, 8 Suppl, august 1994, pp. 1517S - 1523S. Adus la 16 aprilie 2018 .
- ^ Fürst P, Stehle P, Care sunt elementele esențiale necesare pentru determinarea necesităților de aminoacizi la om? , în Jurnalul de nutriție , vol. 134, 6 Suppl, iunie 2004, pp. 1558S - 1565S, PMID 15173430 .
- ^ Reeds PJ, aminoacizi dispensabili și indispensabili pentru oameni , în The Journal of Nutrition , vol. 130, nr. 7, iulie 2000, pp. 1835S - 40S, PMID 10867060 .
- ^ Driscoll DM, Copeland PR, Mecanismul și reglarea sintezei selenoproteinelor , în Revista anuală a nutriției , vol. 23, n. 1, 2003, pp. 17–40, DOI : 10.1146 / annurev.nutr.23.011702.073318 , PMID 12524431 .
- ^ Krzycki JA, The direct genetic encoding of pirrolysine , în Current Opinion in Microbiology , vol. 8, nr. 6, decembrie 2005, pp. 706-12, DOI : 10.1016 / j.mib . 2005.10.009 , PMID 16256420 .
- ^ Wolosker H, Dumin E, Balan L, Foltyn VN, D-aminoacizi în creier: D-serină în neurotransmisie și neurodegenerare , în The FEBS Journal , vol. 275, nr. 14, iulie 2008, pp. 3514-26, DOI : 10.1111 / j.1742-4658.2008.06515.x , PMID 18564180 .
- ^ Qian Wang, Angela R. Parrish și Lei Wang, Extinderea codului genetic pentru studii biologice , în Chimie și biologie , vol. 16, n. 3, 27 martie 2009, pp. 323–336, DOI : 10.1016 / j.chembiol.2009.03.001 . Adus la 16 aprilie 2018 .
- ^ Jianming Xie și Peter G. Schultz, Adăugarea aminoacizilor la repertoriul genetic , în Current Opinion in Chemical Biology , vol. 9, nr. 6, decembrie 2005, pp. 548–554, DOI : 10.1016 / j.cbpa.2005.10.011 . Adus la 16 aprilie 2018 .
- ^ Acest lucru se aplică numai aminoacizilor cu lanțuri laterale neîncărcate. Aminoacizii cu lanț lateral încărcat (acid sau bazic), în care formele ionizate ale grupurilor încărcate ale lanțului lateral sunt adăugate la sarcinile grupelor alfa-carboxilice și alfa-amino, la pH fiziologic se vor găsi de preferință în forma protonată sau deprotonată.în funcție de valoarea pKr respectivă. În special, la pH fiziologic, aminoacizii acizi (Asp, Glu) posedă o grupare carboxilică pe lanțul lateral care se găsește în principal în forma deprotonată (COO-), astfel încât aminoacidul în ansamblu are o sarcină negativă netă ( forma anionică). Aminoacizii bazici (Lys, Arg) au o grupă amino pe lanțul lateral care se găsește în principal în forma protonată (NH3 +), pentru care aminoacidul în ansamblu are o sarcină netă pozitivă (formă cationică). Ultimul grup include, de asemenea, histidina, care are două grupări ionizabile pe inelul imidazol (grupa iminco și grupa amino), fiecare dintre acestea fiind caracterizată de un pK. În special, pK al grupului imino este de 6,7, deci apropiat de pH-ul fiziologic. Aceasta înseamnă că inelul imidazol al histidinei în condiții fiziologice poate oscila cu ușurință între formele deprotonate și protonate, la variații minime ale pH-ului. Această proprietate este exploatată de numeroase enzime, care folosesc histidina pentru a efectua transferuri de protoni. În ceea ce privește cealaltă grupă ionizabilă a grupului imidazol (grupa amino) aceasta are un pK de 14,4, prin urmare la pH fiziologic se găsește de preferință în forma protonată.
- ^ J. Kyte și RF Doolittle, O metodă simplă pentru afișarea caracterului hidropatic al unei proteine , în Journal of Molecular Biology , vol. 157, nr. 1, 5 mai 1982, pp. 105-132. Adus la 16 aprilie 2018 .
- ^ Lukasz P. Kozlowski, Proteome-pI: baza de date a punctelor izoelectrice proteome , în Nucleic Acids Research , vol. 45, D1, 4 ianuarie 2017, pp. D1112 - D1116, DOI : 10.1093 / nar / gkw978 . Adus la 16 aprilie 2018 .
- ^ DR Lide, Manual de chimie și fizică, ediția a 72-a , Boca Raton, Florida, presa CRC, 1991.
Elemente conexe
- Aminoacizi proteinici
- Aminoacizi neproteinogenici
- Aminoacizi esențiali
- Aminoacizi glucogeni
- Aminoacizi cetogeni
- Aminoacizi insulinogenici
- Degradarea streckerului
- Legătură peptidică
- Peptide
- Proteină
- Proteoliza
- Proteosinteza
- Racemizarea aminoacizilor
- Homokiralitatea
- Cod genetic
- Secvența ADN
- Experimentul Miller-Urey
Alte proiecte
-
 Wikționarul conține dicționarul lema « aminoacizi »
Wikționarul conține dicționarul lema « aminoacizi » -
 Wikimedia Commons conține imagini sau alte fișiere despre aminoacizi
Wikimedia Commons conține imagini sau alte fișiere despre aminoacizi
linkuri externe
- Aminoacid , pe Treccani.it - Enciclopedii online , Institutul Enciclopediei Italiene .
- ( EN ) Aminoacid , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
- ( RO ) Lucrări referitoare la aminoacizi , în Biblioteca deschisă , arhivă Internet .
- Aminoacid , în Treccani.it - Enciclopedii online , Institutul Enciclopediei Italiene.
| Controllo di autorità | Thesaurus BNCF 49 · LCCN ( EN ) sh85004486 · GND ( DE ) 4142205-3 · BNF ( FR ) cb11944322s (data) · NDL ( EN , JA ) 00560236 |
|---|