Treonina
| Treonina | |
|---|---|
| Numele IUPAC | |
| L-treonină | |
| Abrevieri | |
| T. Thr | |
| Denumiri alternative | |
| Acid 2 ( S ) -amino-3 ( R ) -hidroxibutanoic Acid α-amino-β-hidroxibutiric | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 4 H 9 NU 3 |
| Masa moleculară ( u ) | 119.12 |
| Aspect | solid cristalin alb |
| numar CAS | |
| Numărul EINECS | 201-300-6 |
| PubChem | 6288 |
| DrugBank | DBDB00156 |
| ZÂMBETE | C[C@H]([C@@H](C(=O)O)N)O |
| Proprietăți fizico-chimice | |
| Constanta de disociere a acidului la 293 K. | pK 1 : 2,09 pK 2 : 9.10 |
| Punctul isoelectric | 5,64 |
| Solubilitate în apă | 200 g / L la 298 K. |
| Coeficientul de partiție 1-octanol / apă | -0,7 |
| Temperatură de topire | 255 ° C (528 K) |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | −807,2 |
| Proprietăți toxicologice | |
| LD 50 (mg / kg) | 3098 (intraperitoneal, șobolan) |
| Informații de siguranță | |
| Fraze H | --- |
| Sfaturi P | --- [1] |
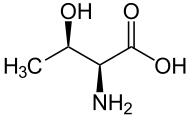
Treonina , Thr sau T [2] , este un α- aminoacid utilizat în biosinteza proteinelor . Structura sa conține o grupare carboxil , care în condiții fiziologice apare sub formă deprotonată ; cu privire la aceasta găsim în poziția α o funcție amino primară care în condiții fiziologice apare sub formă protonată și un lanț lateral polar care conține o grupare hidroxil . În condiții de pH fiziologic, treonina se găsește ca un zwitterion neutru și polar. Este un aminoacid esențial, deoarece nu este sintetizat de corpul uman: poate fi luat doar prin dietă. Când ne referim la treonină, ne referim la L-treonină, adică stereoizomerul acid- (2 S , 3 R ) -2-amino-3-hidroxibutanoic, aceasta este de fapt configurația naturală. [3]
Surse de hrana
Treonina este unul dintre aminoacizii care alcătuiesc atât proteine animale cât și vegetale și peptide . Se presupune că, pentru un adult, necesarul zilnic este de 15 mg / kg de greutate corporală. [4] Exemplele din tabelul următor raportează cele mai abundente surse alimentare de treonină pe baza a 100 g de alimente; procentul este indicat pe cantitatea totală de proteine. [5]
| Alimente | Treonina [g / 100 g de alimente] | Proteine [g / 100 g de alimente] | Treonină / Proteine [%] |
|---|---|---|---|
| Albus de ou deshidratat | 3,69 | 81.1 | 2,99 |
| Izolat de proteine din soia | 3.14 | 88,32 | 2,77 |
| Spirulina deshidratată | 2.29 | 57,47 | 1.32 |
| cod | 2,75 | 62,82 | 1,73 |
| Soia | 1,95 | 49.2 | 0,96 |
| Făină de arahide | 1,79 | 52.2 | 0,93 |
| Lapte praf | 1.6 | 35,5 | 0,57 |
| Crupă de vițel | 1,56 | 35,73 | 0,56 |
| Carne de vită degresată gătită | 1,56 | 29.7 | 0,46 |
| parmezan | 1,53 | 37,86 | 0,58 |
| Făină de soia | 1,51 | 38.09 | 0,58 |
| Slănină | 1.5 | 33,92 | 0,51 |
| Carne de iepure gătită | 1,48 | 33.02 | 0,49 |
| Cereale | 1.32 | 35,75 | 0,47 |
În alimentele indicate, treonina este prezentă aproape exclusiv ca reziduu peptidic și nu sub formă liberă.
Istorie
Treonina a fost ultimul dintre cei 20 de aminoacizi proteici obișnuiți care au fost descoperiți. A fost identificat în 1936 de William Cumming Rose, în colaborare cu Curtis Meyer. Acest aminoacid a fost numit treonină deoarece are o structură similară cu acidul treonic , o monozaharidă cu o formulă moleculară . [6]
Chimie
Stereochimie
Dintre aminoacizii proteinogeni, treonina face parte, împreună cu izoleucina , din familia restrânsă de α-aminoacizi naturali care conțin două centre stereogene. Există patru stereoizomeri posibili și, respectiv, au configurație absolută : (2 S , 3 R ), (2 R , 3 S ), (2 S , 3 S ) și (2 R , 3 R ). Când vorbim despre L-treonină, ne referim la stereoizomerul (2 S , 3 R ), cel mai reprezentat în natură. Stereoizomerul (2 S , 3 S ) numit L-alotreonină [2] poate fi găsit rar în compuși biologici, în principal ca metabolit al plantelor. [7]
  |
| L- treonină (2 S , 3 R ) și D- treonină (2 R , 3 S ) |
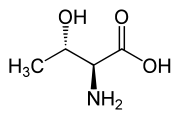 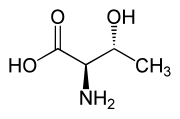 |
| L - alo- treonină (2 S , 3 S ) și D - alo- treonină (2 R , 3 R ) |
Biochimie
Treonina este unul dintre aminoacizii cu lanț lateral polar . În interiorul proteinelor, reziduurile treonine pot fi găsite în porțiunea centrală a structurii secundare a foii β : doar pentru acest aminoacid este poziția preferențială. [8] [9]
Atunci când sunt prezente în helici α, reziduurile treoninei modifică structura normală a acestora: [10] lanțul lateral al treoninei formează adesea legături de hidrogen cu serină dând naștere unor motive recurente, cum ar fi rotirea ST [11] , motivul ST [ 12] [13] și capse ST. [14] [15]
Similar serinei , grupul său lateral poate suferi o reacție de O- glicozilare , adică adăugarea unei molecule de glucoză , precum și fosforilarea (cu serină , tirozină , hidroxiprolină și hidroxilizină ): aceasta este o caracteristică fundamentală, de exemplu, pentru a explica funcționarea receptorilor de membrană celulară .
Biosinteza
Treonina, după cum sa menționat, nu este sintetizată în corpul uman, dar sinteza sa poate fi găsită în alte tipuri de organisme. Biosinteza treoninei în E. coli începe cu formarea piruvatului din glucoză prin glicoliză . [16] Piruvatul este oxidat în acid oxaloacetic de piruvat carboxilaza . Acesta din urmă suferă transferul unei grupări amino prin intermediul aspartatului transaminazic pentru a forma L-aspartat . [17] Pornind de la L-aspartat, încep o serie de căi metabolice care conduc la sinteza diferiților aminoacizi: lizină , metionină , izoleucină , glicină și treonină; diagrama din lateral arată singura cale care duce la aminoacidul de interes. [18] În acest caz:
- L-aspartatul este fosforilat în aspartil-β-fosfat de către enzima aspartat kinază care consumă ATP. La acest nivel există controlul inhibitor al căii de sinteză prin retroinhibiție din produsul final dat chiar de treonină.
- În acest moment, substratul suferă o reducere cu îndepărtarea grupării fosfat și formarea grupării aldehide a aspartil semialdehidelor de către aspartatul-semialdehidă dehidrogenază , consumând .
- Ulterior aspartil semialdehida este redusă la L-homoserină de către homoserina dehidrogenază , consumând în continuare .
- Apoi, există o O-fosforilare a L-homoserinei de către homoserin kinaza pentru a produce 4-fosfo-L-homoserină prin consumul de ATP.
- Acesta din urmă este de-fosforilat de liasa treonină sintază formând L-treonină. [16]
Catabolism
L-treonina este catabolizată într-un sistem complex de căi metabolice, care ca atare este dificil de raționalizat unitar. În total, există patru căi principale de degradare: [19]
- În primul rând, treonina este catabolizată de treonină dehidratază în 2-oxabutanoat, care este transformat în propanoil-CoA [20]
- În al doilea mod, treonina este oxidată de L-treonină 3-dehidrogenază pentru a forma L-2-amino-3-oxobutanoat prin , ulterior scindată de 2-amino-3-ketobutirat CoA ligază în glicină și acetil-CoA: această cale a fost observată în arheobacterii [21] , bacterii [22] , ciuperci [23] , păsări [24] și mamifere [25] ] . În absența ultimei enzime, L-2-amino-3-oxobutanoat se transformă în 1-amino-2-propanonă; acesta din urmă poate fi transformat în metilglioxal , datorită oxigenului și amino oxidazei . [26]
- În cea de-a treia cale metabolică, diferit de cele spuse pentru a doua, în loc de metilglioxal, L-treonina se transformă în (R) -amino-2-propanol O-2 fosfat, datorită acțiunii L-treonin kinazei. [27]
- În al patrulea mod, scindează treonina direct în glicină și acetaldehidă prin enzima L-treonină aldolază; această din urmă cale a fost demonstrată datorită studiilor asupra unor tulpini de Pseudomonas putida . [28]
Niciuna dintre aceste căi nu este complet reprezentată într-un singur organism: diagrama prezentată este rezumatul majorității căilor metabolice descoperite.
Producție
L-treonina nu este produsă prin sinteză chimică, deoarece procesul nu este convenabil din punct de vedere economic, datorită formării diastereomerului (2 S , 3 S ), ceea ce face ca purificarea produsului să fie prea costisitoare. [29] [30] Prin urmare, este preferată sinteza prin fermentare , folosind un bioreactor în care se realizează creșterea bacteriilor adecvate pentru a produce cantități mari de L-treonină într-o manieră stereoselectivă . Odată finalizată faza de fermentare, există o separare a biomasei celulare cu tehnici de ultrafiltrare sau centrifugare : biomasa obținută poate fi utilizată în formularea îngrășămintelor. [31] În trecut, în acest moment, am procedat la o separare a coloanelor de schimb ionic de aminoacizi, dar această tehnică a căzut în uz din cauza progreselor în domeniul tehnic. [29] [31] În prezent, continuăm cu tratamentul băuturilor mamă prin ajustarea pH - ului amestecului obținut: controlul pH-ului este extrem de important pentru fazele de cristalizare ulterioare, de fapt se constată că anumiți aminoacizi cristalizează doar din soluții găsite într-un interval specific de pH. Prin urmare, este necesar să-l controlăm pentru a obține o cristalizare într-un mod selectiv către un aminoacid și cât mai cantitativ posibil. [32] [33] Procesarea se desfășoară cu faze succesive de concentrație termică și, în final, are loc cristalizarea L-Treoninei. [29] Ultima etapă de producție este separarea cristalelor de băuturile mamă, care sunt reciclate, și uscarea produsului obținut. [31] [32]
Utilizări
Om
Amestecurile de aminoacizi pot fi găsite, de asemenea, în comerț și conțin treonină, folosită în general pentru nutriția părintească. [34]
Aplicarea sa în neurologie a fost studiată pentru tratamentul bolilor precum scleroza laterală amiotrofică [35] [36] , scleroza multiplă [37] [38] [39] și spasticitatea [40] : acestea nu sunt încă dovezi științifice privind utilitatea de terapii de acest tip și, într-adevăr, în unele cazuri, au fost evidențiate chiar și posibile tendințe negative, care nu au fost încă demonstrate. [35]
Fermă
Suplimentele de L-treonină sunt, de asemenea, utilizate în industria producției de furaje: în acest caz s-a dovedit că poate îmbunătăți imunitatea, sănătatea intestinală, capacitățile antioxidante și performanța de creștere a găinilor la o vârstă fragedă. [41] Un exces de suplimentare la găinile ouătoare a demonstrat, de asemenea, creșterea performanței ouătoare și a unității Haugh . [42] Ambii factori descriși par a fi importanți deoarece limitează utilizarea resurselor naturale.
Organocataliza
Mulți derivați ai treoninei, în special derivații O- terț- butildimetilsilil, sunt utilizați ca organocatalizatori în reacțiile de condensare aldol stereoselective și variante ale acestora, ale cetonelor ciclice cu aldehide : mecanismul de acțiune este că prin enamină și tehnica oferă randamente bune cu excese enantiomerice mari. [43] [44] [45] [46] Utilizarea acestor catalizatori este deosebit de utilă, deoarece L-treonina este disponibilă comercial sub formă de enantiopuri la prețuri foarte accesibile.
Notă
- ^ Foaie tehnică L-treonină Merk , la sigmaaldrich.com . Adus 14-11-2018 .
- ^ a b ( EN ) Comisia mixtă IUPAC-IUB pentru nomenclatura biochimică, nomenclatura și simbolismul pentru aminoacizi și peptide (Recomandări 1983) ( XML ), în Chimie pură și aplicată , vol. 56, nr. 5, 1 ianuarie 1984, pp. 595-624, DOI : 10.1351 / pac198456050595 . Adus pe 9 noiembrie 2018 .
- ^ Lehninger, Albert L. și Cox, Michael M., principiile Lehninger ale biochimiei. , Ediția a 3-a, Worth Publishers, 2000, ISBN 1572591536 ,OCLC 42619569 . Adus la 12 decembrie 2018 .
- ^ (EN) Sudhir Borgonha, Meredith M. Regan și Seung-Ho Oh, necesitatea treoninei pentru adulți sănătoși, derivată cu o tehnică de echilibru a aminoacizilor indicator de 24 de ore , în The American Journal of Clinical Nutrition, Vol. 75, nr. 4, 2002-4, pp. 698-704, DOI : 10.1093 / ajcn / 75.4.698 . Adus pe 9 noiembrie 2018 .
- ^ (EN) Baze de date USDA privind compoziția alimentelor , pe ndb.nal.usda.gov. Adus pe 9 noiembrie 2018 .
- ^ (EN) Robert D. Simoni, Robert L. Hill și Martha Vaughan, Discovery of the amino acid acid Treonine: the Work of William C. Rose , în Journal of Biological Chemistry, vol. 277, nr. 37, 13 septembrie 2002, pp. e25 - e25. Adus pe 9 noiembrie 2018 .
- ^ (EN) Baza de date a metabolomului uman Afișând metabocard pentru L-Allothreonine (HMDB0004041) pe www.hmdb.ca. Adus pe 9 noiembrie 2018 .
- ^ (EN) Nicholus Bhattacharjee și Parbati Biswas, Propensități specifice poziției aminoacizilor în catena β și în BMC Structural Biology, vol. 10, 28 septembrie 2010, p. 29, DOI : 10.1186 / 1472-6807-10-29 . Adus la 13 noiembrie 2018 .
- ^ (EN) Patrice Koehl și Michael Levitt, Preferințe conformaționale structurale ale aminoacizilor , în Proceedings of the National Academy of Sciences din Statele Unite ale Americii, vol. 96, nr. 22, 26 octombrie 1999, pp. 12524-12529. Adus la 13 noiembrie 2018 .
- ^ (EN) Juan A. Ballesteros, Xavier Deupi și Mireia Olivella, Serine and Treonine Residues Bend α-Helices in the χ1 = g- Conformation , in Biophysical Journal, vol. 79, nr. 5, 2000-11, pp. 2754-2760, DOI : 10.1016 / s0006-3495 (00) 76514-3 . Adus pe 14 noiembrie 2018 .
- ^ (EN) William J. Duddy, Willem J. M. Nissink și Frank H. Allen, Mimicry by asx- and ST-turns of the four main types of β-turn in protein in Protein Science: A Publication of the Protein Society , vol. 13, n. 11, 2004-11, pp. 3051-3055, DOI : 10.1110 / ps.04920904 . Adus pe 14 noiembrie 2018 .
- ^ (EN) W. Wan, EJ Milner-Whine, Un motiv recurent cu două legături de hidrogen care încorporează un reziduu de serină sau treonină se găsește la ambii termeni α-elicoidali și în alte situații , în Journal of Molecular Biology, vol. 286, nr. 5, 12 martie 1999, pp. 1651-1662, DOI : 10.1006 / jmbi.1999.2551 . Adus pe 14 noiembrie 2018 .
- ^ (EN) Alexandre Atkinson, Jérôme Graton și Jean-Yves Le Questel, Prezentări într-o rețea extrem de conservată de legături de hidrogen în site-ul de legare agonist al receptorilor nicotinici de acetilcolină: Studii structurale și teoretice , în Proteine: Structură, Funcție și Bioinformatică , vol. 82, nr. 10, 28 iunie 2014, pp. 2303-2317, DOI : 10.1002 / prot . 24589 . Adus pe 14 noiembrie 2018 .
- ^ (EN) Grey TM, Matthews BW, Legarea hidrogenului intrahelic al reziduurilor de serină, treonină și cisteină în helice α și relevanța sa pentru proteinele legate de membrană , în Journal of Molecular Biology, vol. 175, nr. 1, 5 mai 1984, pp. 75-81, DOI : 10.1016 / 0022-2836 (84) 90446-7 . Adus pe 14 noiembrie 2018 .
- ^ (EN) Ballesteros JA, Deupi X., M. Olivella, Haaksma EEJ, Pardo L., Serine and Treonine Residues Bend α-Helices in the χ1 = g- Conformation , în Biophysical Journal, vol. 79, nr. 5, 1 noiembrie 2000, pp. 2754-2760, DOI : 10.1016 / S0006-3495 (00) 76514-3 . Adus pe 14 noiembrie 2018 .
- ^ A b (EN) Xunyan Dong, Peter J. Quinn și Wang Xiaoyuan, Ingineria metabolică a Escherichia coli și Corynebacterium glutamicum pentru producția de L-treonină , în Biotechnology Advances, vol. 29, nr. 1, 2011-01, pp. 11-23, DOI : 10.1016 / j.biotechadv.2010.07.009 . Adus la 12 noiembrie 2018 .
- ^ (EN) GS Andriiash, GM Zabolotnа, AF Tkachenko, Ya. B. Blume și S. М. Shulga, Threonine Synthesis of Brevibacterium Flavum Mutant Strain , Jacob Coleman.
- ^ (EN) Atsushi Yokota și Isamu SHIIO, deficit de dihidrodipicolinat sintază al tulpinii Brevibacterium flavum BB69, un mutant producător de treonină cu o homoserină dehidrogenază rezistentă la feedback. , în Chimie agricolă și biologică , vol. 54, nr. 2, 1990, pp. 547-548, DOI : 10.1271 / bbb1961.54.547 . Adus la 12 noiembrie 2018 .
- ^ (EN) Superpathway MetaCyc al metabolismului L-treoninei , pe biocyc.org. Adus la 13 noiembrie 2018 .
- ^ (EN) Edwin H. Umbarger și Barbara Brown,dezaminare treonină ÎN ESCHERICHIA COLI II. , în Jurnalul de bacteriologie , vol. 73, nr. 1, 1957-01, pp. 105-112. Adus la 13 noiembrie 2018 .
- ^ (EN) Machielsen Ronnie și John van der Oost, Producția și caracterizarea unei L-treonină dehidrogenază termostabilă din arheonul hipertermofil Pyrococcus furiosus , în Jurnalul FEBS, vol. 273, nr. 12, 2006-6, pp. 2722-2729, DOI : 10.1111 / j.1742-4658.2006.05290.x . Adus la 13 noiembrie 2018 .
- ^ (EN) R. Potter, V. Kapoor și EB Newman, Rolul treoninei dehidrogenazei în degradarea treoninei Escherichia coli , în Journal of Bacteriology, vol. 132, nr. 2, 1977-11, pp. 385-391. Adus la 13 noiembrie 2018 .
- ^ (EN) SV Kovaleva, AI Dorozhko și SE Rabinovich, [Proprietăți cinetice și alosterice ale L-treoninei dehidrogenazei biosintetice foarte purificate din drojdia de bere Saccharomyces carlsbergensis] , în Biokhimiia (Moscova, Rusia), vol. 49, nr. 4, 1984-4, pp. 540-546. Adus la 13 noiembrie 2018 .
- ^ (EN) și JH Yuan RE Austic, Efectul nivelului de proteine dietetice asupra activității treonine dehidrogenazei la găini în Poultry Science, vol. 80, n. 9, 2001-9, pp. 1353-1356, DOI : 10.1093 / ps / 80.9.1353 . Adus la 13 noiembrie 2018 .
- ^ (EN) RA Dale, Catabolismul treoninei la mamifere prin cuplarea L-treonine dehidrogenazei-3 cu 2-amino-3-oxobutiratul-CoA ligază , în Biochimica Et Biophysica Acta, vol. 544, n. 3, 18 decembrie 1978, pp. 496-503. Adus la 13 noiembrie 2018 .
- ^ (EN) S. Komatsubara, K. Murata și M. Kisumi, Treonine degradation by Serratia marcescens , în Journal of Bacteriology, vol. 135, nr. 2, 1978-8, pp. 318-323. Adus la 13 noiembrie 2018 .
- ^ (EN) C. Grabau și JR Roth, A mutant cu deficit de cobalamină de Salmonella typhimurium blocat în sinteza 1-amino-2-propanolului , în Journal of Bacteriology, vol. 174, nr. 7, 1992-4, pp. 2138-2144. Adus la 13 noiembrie 2018 .
- ^ (EN) JG Morris, Utilizarea L-treononinei de către o pseudomonadă: un rol catabolic pentru L-treonină aldolază. , în Biochemical Journal , vol. 115, nr. 3, 1969-11, pp. 603-605. Adus la 13 noiembrie 2018 .
- ^ a b c ( FR ) Ootani M., Kitahara T., Akashi K., Procede pour la purification de la l-treonine , 24 septembrie 1986. Adus 13 noiembrie 2018 .
- ^ (EN) HE Carter, West. HD, dl-Treonină , în Sinteze organice , vol. 20, 1940, p. 101, DOI : 10.15227 / orgsyn.020.0101 . Adus la 13 noiembrie 2018 .
- ^ A b c (EN) Faurie R., J. Thommel, Producția microbiană de L-aminoacizi | SpringerLink ( PDF ), în Advances in Biochemical Engineering Biotechnology , vol. 79, p. 1-35, DOI : 10.1007 / 3-540-45989-8.pdf . Adus la 13 noiembrie 2018 .
- ^ a b ( EN ) Hermann T., Producția industrială de aminoacizi de către bacteriile corineforme , în Journal of Biotechnology , vol. 104, nr. 1-3, 4 septembrie 2003, pp. 155-172, DOI : 10.1016 / S0168-1656 (03) 00149-4 . Adus la 13 noiembrie 2018 .
- ^ (EN) Österberg T., T. Wadsten, Starea fizică a l-histidinei după liofilizare și depozitare pe termen lung , în European Journal of Pharmaceutical Sciences, vol. 8, nr. 4, 1 august 1999, pp. 301-308, DOI : 10.1016 / S0928-0987 (99) 00028-7 . Adus la 13 noiembrie 2018 .
- ^ (EN) Leonard John Hoffer, Nutriție parenterală: aminoacizi , în nutrienți, vol. 9, nr. 3, 10 martie 2017, DOI : 10.3390 / nu9030257 . Adus la 13 noiembrie 2018 .
- ^ a b ( EN ) R. Tandan, MB Bromberg și D. Forshew, Un studiu controlat al terapiei cu aminoacizi în scleroza laterală amiotrofică: I. Date clinice, funcționale și cuplul izometric maxim , în Neurologie , vol. 47, nr. 5, 1996-11, pp. 1220-1226. Adus la 13 noiembrie 2018 .
- ^ (EN) Reto Baldinger, Hans Dieter Katzberg și Markus Weber, Tratamentul crampelor în scleroza laterală amiotrofică / boala neuronului motor , în Cochrane Database of Systematic Reviews, n. 4, 18 aprilie 2012, pp. CD004157, DOI : 10.1002 / 14651858.CD004157.pub2 . Adus la 13 noiembrie 2018 .
- ^ (EN) SL Hauser, TH Doolittle și M. Lopez-Bresnahan, Un efect antispastic al treoninei în scleroza multiplă , în Archives of Neurology, vol. 49, nr. 9, 1992-9, pp. 923-926. Adus la 13 noiembrie 2018 .
- ^ (EN) A. Lee și V. Patterson, Un studiu dublu-orb al L-treoninei la pacienții cu spasticitate spinală , în Acta Neurologica Scandinavica, vol. 88, nr. 5, 1993-11, pp. 334-338, DOI : 10.1111 / j.1600-0404.1993.tb05353.x . Adus la 13 noiembrie 2018 .
- ^ (EN) David Shakespeare, Mike Boggild și Carolyn A Young, Agenți anti-spasticitate pentru scleroza multiplă , în Cochrane Database of Systematic Reviews, 20 octombrie 2003, DOI : 10.1002 / 14651858.cd001332 . Adus la 13 noiembrie 2018 .
- ^ (EN) Hsieh, Wolfe, Connolly, Townson, Curt, Blackmer, Sequeira, Aubut, Spasticity After Spinal Cord Injury: An Evidence-based Review of Current Interventions , in Topics in Spinal Cord Injury Rehabilitation, vol. 13, n. 1, 2007-07, pp. 81-97, DOI : 10.1310 / sci1301-81 . Adus la 13 noiembrie 2018 .
- ^ (EN) YP Chen, YF Cheng și Li XH,Efectele suplimentării treoninei asupra performanței de creștere, imunității, stării oxidative, integrității intestinale și funcției de barieră a broilerilor la vârste fragede , în Poultry Science, vol. 96, nr. 2, 14 iulie 2016, pp. 405-413, DOI : 10.3382 / ps / pew240 . Adus la 13 noiembrie 2018 .
- ^ (EN) MMM Azzam, C. Yuan și GH Liu, Efectul excesului de treonină dietetică asupra performanței ouătoare, calității ouălor, aminoacizilor fără ser, enzimelor digestive și activităților găinilor ouătoare în perioada postpeak , în The Journal of Applied Poultry Research , vol. 23, n. 4, 18 noiembrie 2014, pp. 605-613, DOI : 10.3382 / japr . 2013-00913 . Adus la 13 noiembrie 2018 .
- ^ (EN) Wu Xiaoyu, Zhaoqin Jiang și Shen Han-Ming, organocatalizatori derivați de treonină extrem de eficienți pentru reacțiile aldolice asimetrice directe în apă în sinteza avansată și cataliză, vol. 349, nr. 6, 2 aprilie 2007, pp. 812-816, DOI : 10.1002 / adsc.200600564 . Adus la 13 noiembrie 2018 .
- ^ (EN) Li-Wen Xu Yixin și Lu, aminoacizi primari: catalizatori privilegiați în organocataliza enantioselectivă , în Chimie organică și biomoleculară, vol. 6, nr. 12, 2008, p. 2047, DOI : 10.1039 / B803116A . Adus la 13 noiembrie 2018 .
- ^ (EN) C. Wu, X. Fu, X. Ma, Li S., Sinteza eficientă într-o singură etapă a organocatalizatorilor combinati treonină-surfactant pentru reacțiile aldolice directe foarte enantioselective ale cetonelor ciclice cu aldehide aromatice în prezența apei , în Tetraedru: Asimetrie , vol. 21, n. 20, 28 octombrie 2010, pp. 2465-2470, DOI : 10.1016 / j.tetasy.2010.09.006 . Adus la 13 noiembrie 2018 .
- ^ (RO) C. Wu, Fu X., Li S., Organocatalizatori simpli și ieftini pe bază de treonină pentru reacțiile anti-sin-aldol și Mannich extrem de diastereo- și enantioselective ale α-hidroxiacetonei , în Tetraedru: Asimetrie , vol. 22, n. 10, 31 mai 2011, pp. 1063-1073, DOI : 10.1016 / j.tetasy.2011.06.022 . Adus la 13 noiembrie 2018 .
Elemente conexe
Alte proiecte
-
 Wikționarul conține dicționarul lema « treonină »
Wikționarul conține dicționarul lema « treonină » -
 Wikimedia Commons conține imagini sau alte fișiere pe treonină
Wikimedia Commons conține imagini sau alte fișiere pe treonină
linkuri externe
- ( EN ) Treonine , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.