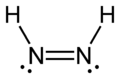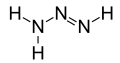Azani
Azani / ˌæzeɪns / sunt idronitrogeni aciclici saturați , constau de fapt doar din atomi de hidrogen și azot și cu toate tipurile de legături individuale . Deci sunt hidruri ale grupului azotat . Deoarece hidronitrogenii ciclici sunt excluși din definiție, azanii cuprind o serie omologă de compuși anorganici cu formula chimică generală N n H n + 2 .
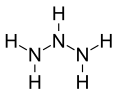
Fiecare atom de azot are trei legături (legături NH și NN) și fiecare atom de hidrogen este atașat la un atom de azot (legături HN). O serie de atomi de azot conectați (NNN ... -N) sunt numiți schelet de azot sau schelet de azot. Numărul de atomi de azot este utilizat pentru a defini mărimea azane ( de exemplu N2 -azane).
Cel mai simplu azane posibil (molecula părinte) este amoniacul , NH3. Nu există limite ale numărului de atomi de azot care pot fi conectați între ei, singurele limitări sunt cele de a fi molecule aciclice, sunt compuși de saturație saturați și sunt hidronitrogeni.
Azanii sunt reactivi și au activitate biologică semnificativă. Azanii pot fi văzuți ca o porțiune biologică activă sau reactivă a ( grupelor funcționale ) ale moleculei, care este inserată în copacii moleculari.
Clasificarea structurii
Hidronitrogeni saturați pot fi:
- Liniar (formula generală N n H n + 2 ) în care atomii de azot sunt uniți într-o structură asemănătoare unui șarpe.
- Ramificat (formula generală N n H n + 2 , n > 3) în care coloana vertebrală a azotului se desparte într-una sau mai multe direcții.
- Ciclici (formula generală N n H n , n > 2) în care coloana vertebrală a azotului este conectată pentru a forma un ciclu continuu.
Conform definiției IUPAC , primele două sunt azani, în timp ce al treilea grup se numește cicloazani . Hidronitrogeni saturați pot fi, de asemenea, o combinație de structură liniară, ciclică (de exemplu policiclică) și ramificată; aceștia sunt încă considerați azani (fără formulă generală) atâta timp cât sunt aciclici (adică fără inele) și au legături covalente unice între atomii de azot.
Izomerism
Azanii cu mai mult de trei atomi de azot pot fi aranjați în mai multe moduri diferite, formând izomeri structurali . Cel mai simplu izomer este cel al atomilor de azot dispuși într-un singur lanț fără ramuri. Acest izomer este numit n-izomer (n pentru "normal", deși nu este întotdeauna cel mai comun). Cu toate acestea, lanțul atomilor de azot poate fi, de asemenea, ramificat în unul sau mai multe puncte. Numărul de izomeri posibili crește rapid pe măsură ce atomii de azot cresc.
Datorită energiei de inversiune reduse, azanii ramificați nesubstituiți nu pot fi chirali . Pe lângă acești izomeri, lanțul de atomi de azot poate forma unul sau mai multe inele. Astfel de compuși sunt numiți cicloazani.
Nomenclatură
Nomenclatura IUPAC are o denumire sistematică a compușilor de azot prin identificarea lanțurilor de hidrogen, analog cu nomenclatura alcanică .
Lanțurile hidrogen-azot saturate și nesaturate sunt denumite cu un prefix numeric grecesc pentru numărul de atomi de azot și sufixul „-azan” pentru hidronitrogeni cu legături simple sau „-azină” pentru cei cu legături duble care se numesc azeni . [1]
Molecula liniara azani
Azanii cu lanț liniar sunt, de asemenea, menționați cu un prefix n - (pentru normal ) atunci când există izomeri neliniari. Deși nu este strict necesară, utilizarea este frecventă în cazurile în care există o diferență majoră de proprietăți între izomerii cu lanț drept și cu lanț ramificat.
Primii membri ai seriei (în ordinea numărului de atomi de azot) sunt numiți după cum urmează:
- amoniac , NH 3 - 1 N atom și 3 H atomi
- hidrazină (sau diazan), N 2 H 4 - 2 N atomi și 4 H atomi
- triazan , N 3 H 5 - 3 N atomi și 5 H atomi
- tetrazan , N 4 H 6 - 4 N atomi și 6 H atomi
Azanii cu trei sau mai mulți atomi de azot sunt denumiți prin adăugarea sufixului - ano la prefixul multiplicator numeric corespunzător. Prin urmare, triazan , N 3 H 5; tetrazane sau tetraazane, N 4 H 6; pentazane sau pentaazane, N 5 H 7; hexazane sau hexazane, N 6 H 8; etc. Prefixul este în general grecesc, cu excepția nonaazano care are un prefix latin , undecaazano și tridecaazano care au un prefix de limbă mixtă.
Molecula liniară azeni
Azenii cu lanț liniar sunt, de asemenea, notați cu un prefix n - (pentru normal ) atunci când există izomeri neliniari.
Primii membri ai seriei (în ordinea numărului de atomi de azot) sunt numiți după cum urmează:
- diazenă sau diazenă, N 2 H 2 - 2 atom N și 2 atomi de H
- triazenă sau triazen, N 3 H 3 - 3 atomi de N și 3 atomi de H
- tetrazen sau tetrazen, N 4 H 4 - 4 N atomi și 4 H atomi
- pentazen sau pentazen, N 5 H 5 - 5 N atomi și 5 H atomi
Pericole
Amoniacul este exploziv atunci când este amestecat cu aer (15 - 25%). Alți azani inferiori pot forma, de asemenea, amestecuri explozive cu aerul. Azanii lichizi mai ușori sunt foarte inflamabili; acest risc crește odată cu lungimea lanțului de azot. Amoniacul este mai ușor decât aerul și se poate acumula pe tavan.
Organoazani
Organoazanii sunt un grup de compuși chimici derivați din azani care conțin una sau mai multe grupări organice. Ele sunt un subset al clasei generale de organonitrogeni, deși distincția nu se face adesea. Deci, organoaminele, organohidrazinele sunt un subset al organoazanilor, primii derivați din amoniac, ultimii din hidrazină.
Pe lângă amine și hidrazine, organoazanii includ, de asemenea, compuși cum ar fi, hidrazone , imine , nitrilii și nitroze , dar exclude compuși precum, dar nu se limitează la compuși azoici .
Se știe că multe hidrazine sunt înlocuite de radicali organici, iar mai multe apar în mod natural. Exemple sunt:
- Monometilhidrazină , CH 3 (NH) NH 2 , unde un atom de H al moleculei de hidrazină este înlocuit cu o grupare metil (CH 3 ). Datorită simetriei moleculei de hidrazină, nu contează ce atom de hidrogen este înlocuit. Este uneori folosit ca combustibil pentru rachete.
- 1,1-dimetilhidrazina , H 2 NN (CH 3 ) 2 , (numită și dimetilhidrazină UDMH-nesimetrică) și 1,2-dimetilhidrazină , (CH 3 NH) 2 (numită și dimetilhidrazină SDMH-simetrică) sunt hidrazine în care doi atomi H sunt înlocuite de grupări metil . UDMH este mai ușor de fabricat decât SDMH, iar UDMH este un combustibil pentru rachete destul de obișnuit.
- Gyromitrin și agaritin sunt derivați de hidrazină găsit în produse comercial Agaricus bisporus specii de ciuperci. Giromitrina este metabolizată în monometilhidrazină.
- Isoniazida , iproniazida , hidralazina și fenelzina sunt medicamente ale căror molecule conțin structuri similare hidrazinei.
- 2,4-Dinitrofenilhidrazina (prescurtată: 2,4-DNPH) este frecvent utilizată pentru testarea cetonelor și aldehidelor în chimia organică și clinică .
- Fenilhidrazină , C 6 H 5 NHNH 2 , prima organohidrazină care a fost izolată.
Hidronitrogeni și derivați înrudiți
Legate de azani sunt o serie omologă de grupări funcționale , lanțuri laterale sau radicali cu formula chimică generală - N n H n + 1 . Exemple sunt azanyl (- NH2) și hidrazinil sau diazanyl (- N 2 H 3). Aceste grupuri sunt în general prescurtate cu simbolurile -N, -N2 ... -Nn .
Notă
- ^ Rețineți că „-azino“, care este folosit pentru cei cu trei legături, este absent pentru că singurul membru al seriei, N 2, nu este un hydronitrogen.
Bibliografie
- A. Earnshaw, Norman Greenwood, Chimia elementelor , Reed Educational and Professional Publishing Ltd, 1997, ISBN 0-7506-3365-4 .