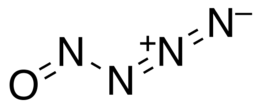Nitrosilazidă
| Nitrosilazidă ( trans ) | |||
|---|---|---|---|
| Numele IUPAC | |||
| Nitrosilazidă [1] [2] | |||
| Abrevieri | |||
| N4O | |||
| Denumiri alternative | |||
| Azoză nitrosilică Oxid de tetranitrogen | |||
| Caracteristici generale | |||
| Formula moleculară sau brută | N 4 O | ||
| Masa moleculară ( u ) | 72.03 [3] | ||
| Aspect | Solid galben pal [4] | ||
| numar CAS | Immagine_3D | ||
| PubChem | 18974641 | ||
| ZÂMBETE | [N-]=[N+]=NN=O | ||
| Proprietăți fizico-chimice | |||
| Temperatură de topire | −60 ° C până la -55 ° C [5] −59 ° C [6] | ||
| Informații de siguranță | |||
| Fraze H | --- | ||
| Sfaturi P | --- | ||
Nitrosilazida este un oxid de azot extrem de instabil, cu formula chimică N 4 O. Este un compus anorganic legat covalent din molecula-poțiuni de azidă și nitrozil . Conținutul de azot din moleculă este de 77,79%.
Sinteză
Prima sinteză a fost realizată în 1958 de chimistul HW Lucien. Această sinteză are loc prin următoarea reacție de azidă de sodiu și clorură de nitrozil la temperatură scăzută: [4] [5]
Sub -50 ° C, compusul există ca un solid galben pal, sub forma unui izomer geometric de tip trans . Produsul se obține prin distilare sub vid din amestecul de reacție.
Peste această temperatură, se descompune în monoxid de dinitrogen (N 2 O) și azot molecular (N 2 ):
În locul clorurii de nitrozil, ca surse de NO pot fi folosiți acid nitrosil sulfuric sau acid azotat . [5]
Proprietate
Presiunea vaporilor în funcție de T este dată de ecuația lui Antoine ca lg (P) = −A / T + B (P în Torr, T în Kelvin) cu A = 1215,6 și B = 7,306. [5] Prin extrapolare, este posibil să se estimeze un punct normal de fierbere a presiunii la temperatura T = 1,5 ° C. Acest punct nu poate fi atins practic, deoarece am spus că compusul se descompune peste -50 ° C. Un calcul de chimie cuantică ab initio a relevat o căldură puternic exotermă de reacție cu -381 kJ · mol -1 la -50 ° C.
Caracterizarea a fost realizată prin spectroscopie în infraroșu [5] și Raman [4] , prin care benzile măsurate sunt de acord cu valorile teoretice calculate pentru un izomer geometric trans . Calculele de chimie cuantică au relevat un izomer de tip cis cu energie de 4,2 kJ · mol -1 și un izomer de structură aromatică cu 6π inel mai stabil în jurul valorii de 54,4 kJ · mol -1 . Pentru reacția de ciclizare, ar trebui aplicată o energie de activare foarte mare de 205 kJ · mol -1 datorită îndoirii funcției azide. [4]
Acest lucru poate fi văzut ca un motiv pentru care nitrozilazida este atât de stabilă și poate fi izolată la temperaturi scăzute. Forma ciclică se descompune rapid așa cum s-a văzut mai sus.
Notă
- ^ Nomenclatura chimiei anorganice: Recomandările IUPAC 2005 (Cartea roșie) , Cambridge, The Royal Society of Chemistry , 2005, ISBN 978-0-85404-438-2 .
- ^ (EN) PubChem Compound, AC1L1C0X - Compound Summary , pe pubchem.ncbi.nlm.nih.gov, Centrul Național pentru Informații despre Biotehnologie, 25 martie 2005. Adus pe 13 octombrie 2011.
- ^ ( EN ) Comisia IUPAC pentru abundențe izotopice și greutăți atomice , greutăți atomice ale elementelor 2017 , la Universitatea Queen Mary din Londra .
- ^ a b c d Schulz, A.; Tornieporth-Oetting, IC; Klapötke, TM : azoză nitrosilică, N 4 O, un oxid de azot intrinsec instabil în Angew. Chem. Ed. Int. 32 (1993) 1610–1612; DOI : 10.1002 / anie.199316101 .
- ^ a b c d și Lucien, HW: Prepararea și proprietățile nitrozil azidei în J. Am. Chem. Soc. 80 (1958) 4458–4460, DOI : 10.1021 / ja01550a004 .
- ^ ( DE ) Römpp Online, Stickstoffoxide , la roempp.thieme.de , Georg Thieme Verlag, 17. aprilie 2014.
- ^ Această substanță nu a fost încă clasificată ca fiind periculoasă sau nu a fost găsită încă o sursă fiabilă și de încredere.
Bibliografie
- Cotton, F. Albert & Geoffrey Wilkinson,Advanced Inorganic Chemistry , 6th, New York, John Wiley & Sons, 1999, p. 331 , ISBN 0-471-19957-5 .