Chlamydomonas reinhardtii
| Chlamydomonas reinhardtii | |
|---|---|
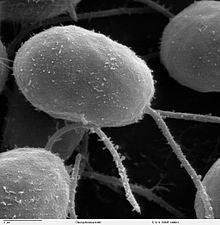
| C.reinhardtii observat sub SEM (10000x) | |
| Clasificare științifică | |
| Domeniu | Eukaryota |
| Regatul | Plantae |
| Phylum | Clorofite |
| Clasă | Cloroficele |
| Ordin | Chlamydomonadales |
| Familie | Chlamydomonadaceae |
| Tip | Chlamydomonas |
| Specii | C. reinhardtii |
| Nomenclatura binominala | |
| Chlamydomonas reinhardtii PADang. | |
Chlamydomonas reinhardtii este o „ algă eucariotă unicelulară, cu diametrul de aproximativ 10 uM, care se mișcă folosind doi flageli (lungi aproximativ 10 m). Trebuie remarcat faptul că nu are nimic de-a face cu bacteria Chlamydia trachomatis , responsabilă de boala venerică cunoscută.
Caracteristici și ciclul de viață
C.reinhardtii este foarte prezent în sol și în bazinele de apă dulce. Are un perete celular , un cloroplast mare și un aparat sensibil la lumină, respectivul spot ocular [1] . În general, diferitele specii de Chlamydomonas pot fi cultivate într-un mediu minim (cu săruri anorganice ) în prezența luminii (pentru a începe fotosinteza ). Dacă li se administrează acid acetic , pot crește chiar și pe întuneric.
C.reinhardtii este prezent în cea mai mare parte sub formă de celule flagelate vegetative, haploide , cu 17 cromozomi mici (pentru un genom de aproximativ 100 de milioane de perechi de baze). Dacă celulele pierd sursa de azot , formează gamete haploide. Există două tipuri sexuale, observației identice, numite mt (+) și mt (-), care se poate topi și formează un zigot diploid . Zigotul nu este flagelat, dar rămâne latent în sol: dacă este expus la lumină, poate merge la meioza întâlnirii, eliberând patru celule haploide flagelate, care reflectă faza vegetativă.
C.reinhardtii este adesea numită drojdie verde, deoarece este fotosintetică (și, prin urmare, autotrofă), dar are caracteristici foarte asemănătoare cu cele ale drojdiilor (cum ar fi Saccharomyces cerevisiae ). Formează cu ușurință colonii pe plăci, are două tipuri sexuale (poate crește atât sub formă haploidă, cât și sub formă diploidă), permite analiza tetradelor (descoperite în Chlamydomonas ) în timpul reproducerii și are o creștere foarte rapidă (o generație durează aproximativ 5 ore). În condiții optime de creștere, celula poate merge, de asemenea, pentru a întâlni două sau trei mitoze înainte ca celulele fiice să fie eliberate în afara peretelui celulei mamă. Astfel, la analiza observatorului, 4-8 celule fiice par a fi produse dintr-un singur eveniment reproductiv.
C.reinhardtii ca organism model
Linia celulară de tip sălbatic considerată pentru organism se numește C137 și mt + sexual . Originea sa este incertă, dar se crede că a fost colectată într-un câmp din New England în patruzeci de ani . Există mulți mutanți cunoscuți ai C. reinhardtii. Mutanții sunt un instrument util pentru studierea unui număr mare de procese biologice, cum ar fi:
- mișcarea prin flageli și reglarea lungimii acestora;
- răspunsul celulei la stimulii luminii;
- mecanismele de recunoaștere între două sau mai multe celule;
- reglarea expresiei genelor;
- formarea și moștenirea cloroplastului;
- răspunsul la modificările concentrației sărurilor anorganice prezente;
- orice proces de producție.
Din aceste motive, C.reinhardtii este un organism model care adună din ce în ce mai mult succes în comunitatea științifică: această algă a devenit de fapt un mic eveniment științific, cu peste 100 de laboratoare importante din lume care au început să o utilizeze în câteva ani. Atractivitatea sa a crescut în continuare în urma publicării datelor referitoare la genomul său. Prima parte a acestuia, de fapt, a fost lansată în februarie 2003 de către Joint Genome Institute din Departamentul de Energie al SUA. Secvențele genomului nuclear din „Există corp , aproape complet, și cele ale mitocondriilor sale (~ 15,8 Kb) și ale cloroplastelor (~ 200 Kb). Există, de asemenea, un număr mare de secvențe de ADNc și EST exprimate.
În studiile de microfluiditate , C.reinhardtii este arhetipul înotătorului, care este tipul de microorganisme care, pentru înot, atrag fluidul spre tine. [2]
Transformarea lui C. reinhardtii
C. reinhardtii este un organism foarte ușor de gestionat în laborator, ceea ce face posibilă o serie de aplicații biotehnologice . Este într-adevăr un organism foarte simplu de transformat: transformarea poate avea loc prin recombinare omologă în cloroplast omolog și nu în nucleu. ADN-ul nuclear este de obicei transformat prin electroporare . Genomul cloroplastului poate fi transformat, totuși, printr-o abordare biobalistico , ardere microprojectilă a ADN-ului organic. De fapt, aceste proceduri reprezintă cel mai eficient mod de transformare a cloroplastului. Acest lucru se datorează probabil faptului că cloroplastul ocupă mai mult de jumătate din volumul celulei, oferind astfel proiectilului o țintă foarte mare.
C. reinhardtii ca sursă curată de hidrogen
Datorită și caracteristicilor sale de organism model pentru genetică, există numeroase domenii de cercetare care utilizează acest microorganism pentru a înțelege diferite procese biologice. Una dintre cele mai promițătoare este cea legată de producția de hidrogen, care implică cantități minime de gaze cu efect de seră, cum ar fi dioxidul de carbon. De fapt, dacă ar fi posibilă utilizarea microalgelor pentru producerea de cantități mari de hidrogen în scopuri energetice, această sinteză ar necesita în esență cele două resurse de energie primară de pe pământ: apa și lumina.
Deja în 1939 , omul de știință german Hans Gaffron ( 1902 - 1979 ), apoi la Universitatea din Chicago , a descris metabolismul „ hidrogenului din algele verzi unicelulare, găsind în acest caz capacitatea celulelor de a consuma hidrogenul . Mai târziu (1942) , același Gaffron a descoperit că întrerupând temporar producția fotosintetică de oxigen , algele verzi au fost capabile să activeze producția de hidrogen pentru o perioadă scurtă de timp înainte ca producția de oxigen să se restabilească. O astfel de reacție, catalizată de o fier - hidrogenază , are loc exclusiv în anaerobioză , condiție absolut necesară deoarece enzima este extrem de sensibilă la ' oxigen . Acest element, de fapt, este capabil să inhibe atât situsul activ al enzimei, cât expresia genei sale. Din punct de vedere biologic, producția de hidrogen pare a fi în esență o supapă de siguranță pentru celulă care, în absența oxigenului , se dovedește a avea un număr excesiv de electroni la cloroplaste, chiar aruncându-i prin activitatea hidrogenazei . Acest lucru permite celulei să păstreze „funcționalitatea motorului” fotosintetic, salvându-l de un exces de putere de reducere și, în același timp, sintetizând ATP , principala sursă de energie utilizată la nivel celular.
În următorii treizeci de ani de descoperit, mulți cercetători au încercat să clarifice în continuare mecanismele care reglementează producția de hidrogen din alge. În ultimii ani, în special, interesul reînnoit pentru sursele de energie regenerabile a dat un impuls suplimentar cercetării în acest domeniu, ducând la dezvoltarea unei prime metode de producere eficientă a hidrogenului în C. reinhardtii. Metoda , descrisă în 2000 de Universitatea Anastasios Melis dell ' din Berkeley ( California , SUA ), constă în privarea mediului de cultura sulfului , un element esențial pentru fotosistemul II responsabil cu fotoliza apei . Această ușă privativă, în aproximativ 24 de ore, către o reducere drastică a fotosintezei și, prin urmare, a producției de oxigen , până când atinge condițiile anaerobe necesare pentru a activa producția de hidrogen . [3] . În aceste condiții, cultura algelor se află în anaerobioză la lumină, situație care nu numai că permite sinteza dell'idrogenasi, ci și un flux constant de electroni către enzima însăși datorită luminii, care este colectată de pigmenții care furnizează în mod normal fotosinteza .
În orice caz, durata sintezei de hidrogen rămâne un factor limitativ pentru orice producție pe scară largă din microorganisme. Motivul principal al acestei scurtități este legat de faptul că, în cazul lipsei de sulf, producția de hidrogen durează maximum o săptămână, ducând în cele din urmă la moartea celulară. În cazul în care utilizați un mediu de cultură complet sau în condițiile în care Gaffron și Rubin au observat pentru prima dată acest fenomen (1942) , producția poate dura de la câteva minute la aproximativ o oră, după care celula este capabilă să restabilească fotosinteza (și, prin urmare, producerea de oxigen ).
Pentru a rezolva această problemă, sunt urmate în prezent diferite strategii, inclusiv:
- rezistența hidrogenazei la oxigen. În acest fel, acumularea de oxigen nu ar mai compromite funcționalitatea enzimei. Acest lucru ar face posibilă o producție continuă de hidrogen prin exploatarea pe deplin a fotosintezei [4] .
- reducerea competitivității cu alte enzime. Deși o enzimă insensibilă la oxigen poate garanta utilizarea fotosintezei complete, rezultând o creștere a productivității în comparație cu ratele actuale, această soluție nu ar rezolva competitivitatea hidrogenazei cu alte enzime care primesc în mod normal electronii fotosintezei, cum ar fi de exemplu Rubisco , responsabil pentru ciclul Calvin , care acționează ca principal acceptor al electronilor în ceea ce privește hidrogenaza . De fapt, această soluție ar trebui realizată în paralel cu o serie de modificări genetice sau fiziologice capabile să reducă alimentarea cu electroni către celelalte căi metabolice, garantând în cele din urmă o alimentare mai mare doar cu hidrogenaza.
- suspendarea temporară, prin manipularea genetică a hidrogenazei, a căilor metabolice specifice. Această abordare intenționează să facă posibilă, cu aceeași cultură algală, pornirea și oprirea expresiei anumitor gene funcționale procesului, alternând fazele de aerobioză și anaerobioză, întârzând semnificativ momentul morții celulare și fluctuația culturii. În cazul fotosintezei, acest lucru ar împiedica oxigenul să atingă un nivel care inhibă producția de hidrogen. [5] . În cazul dell'idrogenasi, suprimarea țintită a expresiei sale ar permite cultivarea întoarcerii la un proces de creștere fiziologică pentru a restabili condițiile de sănătate optime, având în vedere o nouă fază de stres în care se dezvoltă din nou hidrogenul . Recent, a fost publicat un sistem de expresie genică inductibilă a Chlamydomonas [6] și brevetat de un grup de cercetare italian al ENEA din Roma .
După toate probabilitățile, niciuna dintre aceste abordări nu reușește individual să rezolve problema creșterii productivității hidrogenului în C. reinhardtii, în timp ce o integrare funcțională între ele ar putea duce la o îmbunătățire semnificativă a rezultatelor actuale. În acest sens, producția industrială de hidrogen pornind biofotolitic de la microalge nu pare a fi în viitorul apropiat. În teorie, eficiența maximă de conversie energetică a luminii în produse metabolice în organismele fotosintetice este de 10% având în vedere radiația completă a luminii (20% având în vedere doar spectrul luminos vizibil). Cele mai bune rezultate produse în laborator, apoi cu lumină artificială, doar puțin peste 3% și au fost publicate recent de un grup italian al CNR din Florența . În orice caz, prima producție de hidrogen cu alge verzi efectuată cu lumina soarelui, publicată de același grup , în parte pentru a demonstra posibilitatea de a efectua acest proces cu lumina soarelui, a raportat, de asemenea, o reducere semnificativă a productivității. În acest sens, studiul fotobioreactoarelor eficiente și reduse, dedicat în mod special acestui proces, este un element esențial pentru viitor și ca reproducere industrială a acestei biotehnologii .
Notă
- ^ (EN) Mark D. Thompson, M. Mittelmeier Telsa și Carol L. Dieckmann, Chlamydomonas: Molecular Genetics and Physiology , în Microbiology Monographs, Springer International Publishing, 2017, pp. 257-281, DOI : 10.1007 / 978-3-319-66365-4_9 , ISBN 9783319663654 . Adus pe 12 iulie 2019 .
- ^ (RO) David SAINTILLAN, Reology of Fluids Active in Annual Review of Fluid Mechanics, vol. 50, nr. 1, 5 ianuarie 2018, pp. 563-592, DOI : 10.1146 / annurev-fluid-010816-060049 . Adus de 09 iulie 2021.
- ^ Anastasios Melis, Thomas Happe, Trails of green algae hidrogen research - de la Hans Gaffron la noile frontiere (PDF), în Photosynthesis Research, vol. 80, 2004, pp. 401-409, DOI : 10.1023 / B: PRES.0000030421.31730.cb .
- ^ Laurent Cournac, Florence Musa, Laetitia Bernarda, Geneviève Guedeneya, Paulette Vignaisb și Gilles Peltie, Limiting steps of production de hidrogen în Chlamydomonas reinhardtii și Synechocystis PCC 6803 as Analised by light-induced gas exchange transients , în International Journal of Hydrogen Energy, vol. 27, n. 11/12, 2002, pp. 1229-1237, DOI : 10.1016 / S0360-3199 (02) 00105-2 .
- ^ Anastasios Melis, producția de biocombustibili de hidrogen și hidrocarburi prin fotosinteză microalgală , pe epmb.berkeley.edu. Adus pe 7 aprilie 2008 (depus de „url original 3 aprilie 2008).
- ^ (EN) Paola Ferrante, Claudia Catalanotto, Giulia Bonente, Giovanni Giuliano, Un sistem de expresie genică optimizat, reglementat chimic pentru Chlamydomonas pe dx.plos.org. Adus la 17 mai 2021 (depus de „url original 7 februarie 2020).
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere ale Chlamydomonas reinhardtii
Wikimedia Commons conține imagini sau alte fișiere ale Chlamydomonas reinhardtii -
 Wikispecies are informații despre Chlamydomonas reinhardtii
Wikispecies are informații despre Chlamydomonas reinhardtii
linkuri externe
- Decodat genomul lui Chlamydomonas reinhardtii Pe Galileo, 12 octombrie 2007. Accesat la 17 mai 2021 (depus de 'url original 10 martie 2016).
- (EN) Întrebări frecvente despre Chlamydomonas reinhardtii Pe yale.edu. Adus la 23 februarie 2007 (depus de „Adresa URL originală la 23 februarie 2007).
- ( EN ) Chlamy.org: baza de date a Universității Duke care conține informații genomice, genetice, bibliografice despre Chlamydomonas și culturile sale celulare pe chlamy.org.
- (EN) Site-ul predării orientate de C.reinhardtii pe chlamyteach.info. Accesat la 5 martie 2007 (depus de „Adresa URL originală la 24 aprilie 2006).