Electroliză


Electroliza (pronunția corectă: / eletˈtrɔlizi / ; pronunția acceptabilă: / elɛttroˈlizi / [1] ) este un proces care constă în efectuarea de transformări chimice datorită alimentării cu energie electrică ; de aceea există conversia energiei electrice în energie chimică .
Procesul teoretic invers al electrolizei este generarea de energie electrică printr-o baterie ; de fapt, bateria produce energie electrică prin exploatarea transformărilor chimice, în timp ce electroliza exploatează energia electrică pentru ca transformările chimice să aibă loc. Procesul de producere a energiei electrice într-o baterie este un proces spontan , în timp ce procesul de electroliză nu are loc spontan (de fapt este necesar să se furnizeze electricitate din exterior către sistem pentru ca procesul să aibă loc).
Electroliza și disocierea electrolitică
Termenul „electroliză” provine din greacă și înseamnă „a se rupe de electricitate” [2], deoarece în multe cazuri supunerea unei substanțe la electroliză înseamnă descompunerea acesteia în elementele sale constitutive . De exemplu, prin electroliza apei (a cărei moleculă este compusă din doi atomi de hidrogen și un atom de oxigen ) se obțin elementele din care este compusă, adică hidrogen (H 2 ) și oxigen (O 2 ). În cazurile în care electroliza duce de fapt la divizarea unei substanțe în elementele sale constitutive, vorbim mai precis despre disocierea electrolitică .
-
2H 2 O (aq) → 2H 2(g) + O 2(g)
Prin aplicarea unui curent electric continuu , toate acele substanțe care, în soluție sau topite, se descompun în ioni , adică acizi , baze , săruri și apă , suferă disociere electrolitică.
Fenomenul disocierii electrolitice poate apărea în orice caz și fără adăugarea de electricitate din exterior și, pe de altă parte, disocierea electrolitică este doar unul dintre multele fenomene care apar în timpul procesului de electroliză (de exemplu, fenomenele de depunere apar la electrod și polarizare ), pentru care termenii „electroliză” și „disociere electrolitică” nu sunt sinonime.
Legile lui Faraday
Un studiu sistematic asupra electrolizei a fost realizat de Michael Faraday , care, în 1832, a enunțat cele două legi ale sale asupra electrolizei , descoperite de asemenea în mod independent de Carlo Matteucci [3] :
- cantitatea de elemente produse printr-un proces de electroliză este direct proporțională cu cantitatea de sarcină care a trecut prin celula electrolitică;
- cu aceeași încărcare, cantitatea diferitelor elemente obținute este proporțională cu greutățile echivalente ale speciilor chimice.
Efectuarea electrolizei
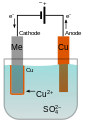
În laborator , experimentele de electroliză sunt efectuate în general pe soluții apoase ; doi electrozi sunt scufundați în soluția apoasă căreia i se aplică un curent electric direct. Prin atracția dintre sarcini opuse, ioni pozitivi ( cationi ) sunt atrași de electrodul negativ ( catod ) și ioni negativi ( anioni ) către electrodul pozitiv ( anod ). [4] În redox normal, electrozii au funcții opuse, adică catodul este cel pozitiv și atrage anioni, iar anodul are în mod evident sarcina opusă, adică să atragă cationii; numai în cazul electrolizei se produce acest „schimb”, deoarece reducerea este forțată prin administrarea de electroni și, prin urmare, „electrozii sunt inversați în rolul lor”.
Când un ion pozitiv intră în contact cu electrodul negativ ( catodul în acest caz) este forțat să dobândească electroni din acesta, adică suferă o reducere . De exemplu, în electroliza unei sări cuprice , ionii cuprici (Cu 2+ ) sunt transformați în cupru metalic (Cu (s) ), care se depune pe suprafața electrodului, conform reacției:
-
Cu 2+ + 2e - → Cu (s)
Când un ion negativ intră în contact cu electrodul pozitiv ( anodul în acest caz) își transferă electronii către el, adică suferă oxidare . Un ion clorură , de exemplu, este transformat într-un atom de clor ; doi atomi de clor din apropiere se combină într-o moleculă diatomică de clor gazos, care se va îndepărta ca gaz, conform reacției:
-
2Cl - → Cl 2 + 2e -
În mod similar, electroliza apei produce hidrogen gazos și oxigen , prin următoarele reacții:
- catod:
2H + + 2e - → H 2 - anod:
2OH - → ½ O 2 + H 2 O + 2e -
Diferența de potențial electric care trebuie aplicată electrozilor pentru a provoca electroliza depinde de potențialele de reducere ale reacțiilor care au loc la fiecare electrod.
Reducerea sau oxidarea substanțelor supuse electrolizei va avea loc în conformitate cu următoarele reguli:
- H + ioni , sub formă de hydroxonium (H 3 O +), ambele derivând din disocierea apei și de aceea a unui de acid , sunt reduse mai ușor decât din metal ionii care hidrogenul precede în scara potențialului de reducere; ajungând la catod captează electroni (reducere), trec în starea atomică și apoi în hidrogen molecular.
- Ionii metalici care urmăresc hidrogenul la scara potențialului de reducere sunt reduși mai ușor decât hidrogenul, ajungând la catod captează electroni (reducere), devin atomi neutri și se depun pe catod sub formă de metal.
- Ionii clorură, Cl - , dacă soluția este concentrată, se oxidează mai ușor decât ionii hidroxil , ajung în anod, eliberează electroni (oxidare) și, prin urmare, există dezvoltarea clorului gazos.
- Anionii oxiacizi și ionii fluorură se oxidează mai puțin ușor decât ionii hidroxil care, reacționând doi câte doi, dau apă și dezvoltă oxigen gazos.
Trebuie luat în considerare faptul că potențialul de reducere variază în funcție de concentrația speciilor implicate în electroliză, prin urmare, în cel mai general caz, este necesar să se utilizeze ecuația Nernst pentru a evalua ce specie se oxidează efectiv și care scade, mai degrabă decât să se bazeze doar pe potențialele redox tabelate (care se referă la o concentrație de 1 M ). În plus, posibila supratensiune , adică surplusul potențial (din cauza unor cauze disipative) care trebuie aplicat electrozilor în raport cu potențialul de reducere simplă al speciilor care participă la electroliză, nu trebuie neglijat. În special, datorită polarizării ridicate, supratensiunea datorată dezvoltării moleculelor gazoase pe suprafața unui electrod (cum ar fi hidrogenul sau oxigenul ) este considerabilă.
Aplicații
Substanța produsă cel mai frecvent prin electroliză într-un mediu industrial este clorul , din saramură ( soluție de clorură de sodiu ) sau din clorură de sodiu topită.
O altă aplicație a electrolizei este electrogravimetria , o metodă analitică foarte precisă, utilă în special pentru determinarea titlului unui aliaj prin cântărirea cantității de metal depusă pe catod.
Galvanizarea și galvanizarea sunt aplicații tehnologice importante care permit acoperirea suprafeței diferitelor materiale cu un strat de metal mai nobil, în scopuri de protecție împotriva coroziunii sau pur și simplu în scopuri decorative sau estetice. Un exemplu în acest sens este procesul de placare cu crom .
Un alt exemplu de aplicare a celulelor electrolitice este generatorul de hidrogen , utilizat pentru efectuarea procesului de electroliză a apei .
Aplicații importante și mai recente se referă la tratarea poluanților conținuți în apele uzate industriale, printre care se acordă o atenție deosebită compușilor organici clorurați, dintre care unii sunt cancerigeni și nu pot fi eliminați prin tratamente biologice (adică „biorefractare”); provin în special din producția de clorură de polivinil (PVC), obținută din clorură de vinil monomer (VCM). În aceste cazuri, procesele de dehalogenare prin reducere electrochimică par deosebit de promițătoare, deoarece permit transformarea compușilor policlorurați în hidrocarburi , care sunt biodegradabile, în timp ce atomii de clor sunt transformați în cloruri anorganice.
Acoperirea unui metal cu cupru prin galvanizare .
Schema procesului Hall-Héroult , un proces electrolitic utilizat pentru producția de aluminiu .
Notă
- ^ Luciano Canepari , electroliza , în Il DiPI - Dicționar de pronunție italiană , Zanichelli, 2009, ISBN 978-88-08-10511-0 .
- ^(EN) Dicționar online de etimologie
- ^ N. D'Amico, Istoria și poveștile școlii italiene , Zanichelli, Bologna 2010, p. 86 n. 19.
- ^ Trebuie să fim atenți să nu generalizăm ceea ce s-a spus despre semnele electrozilor: de fapt, în timp ce în cazul celulelor electrolitice electrodul pozitiv este anodul și electrodul negativ este catodul, în cazul celulelor galvanice opusul apare, deci electrodul pozitiv este catodul și electrodul negativ este anodul.
Elemente conexe
- Celula electrolitică
- Electrogravimetrie
- Echivalent
- Michael Faraday
- Galvanoplastie
- Galvanizare
- Electro-flotație
- Electroliza apei
- Electroliza Kolbe
- Electroliza la temperaturi ridicate
- Marcaj electrolitic
Alte proiecte
-
 Wikționarul conține dicționarul lemă « electroliză »
Wikționarul conține dicționarul lemă « electroliză » -
 Wikimedia Commons conține imagini sau alte fișiere despre electroliză
Wikimedia Commons conține imagini sau alte fișiere despre electroliză
linkuri externe
- ( EN ) Electrolysis , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
- Electroliză: informații generale , pe dsch.univ.trieste.it .
- Electroliza apei , pe itchiavari.org .
- Electroliza unei soluții de iodură de potasiu , pe itchiavari.org .
- Electroliza unei sări topite , pe itchiavari.org .
| Controlul autorității | Tezaur BNCF 20774 · LCCN (EN) sh85042152 · BNF (FR) cb119763237 (data) · NDL (EN, JA) 006 764 557 |
|---|