Pentasulfură de fosfor
| Pentasulfură de fosfor | |
|---|---|
| Numele IUPAC | |
| decasulfură de tetrafosfor | |
| Denumiri alternative | |
| pentasulfură de difosfor, anhidridă tiofosforică, persulfură de fosfor | |
| Caracteristici generale | |
| Formula moleculară sau brută | P 4 S 10 |
| Masa moleculară ( u ) | 444,555 |
| Aspect | galben solid |
| numar CAS | |
| Numărul EINECS | 215-242-4 |
| PubChem | 14817 |
| ZÂMBETE | P12(=S)SP3(=S)SP(=S)(S1)SP(=S)(S2)S3 |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 2.09 |
| Solubilitate în apă | reacționează |
| Temperatură de topire | 288 ° C (561 K) |
| Δ fus H 0 (kJ · mol -1) | 41 |
| Temperatura de fierbere | 514 ° C (787 K) |
| Δ eb H 0 (kJ mol −1 ) | 178 |
| Presiunea de vapori ( Pa ) la 20 ° C K. | <1 hPa |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | −309 |
| Proprietăți toxicologice | |
| LD 50 (mg / kg) | 750 (mouse, oral) |
| Informații de siguranță | |
| Punct de flacără | > 260 ° C |
| Temperatură de autoaprindere | ≈300 ° C |
| Simboluri de pericol chimic | |
   | |
| Pericol | |
| Fraze H | 228 - 260 - 302 - 332 - 400 - EUH029 |
| Sfaturi P | 210 - 223 - 231 + 232 - 273 - 370 + 378 - 422 [1] [2] |
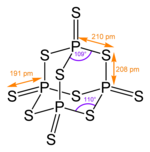
Pentasulfura de fosfor este compusul anorganic cu formula minimă P 2 S 5 . De fapt, este alcătuit din molecule de P 4 S 10 și denumirea mai corectă este tetrafosfor decasulfură . Este una dintre cele două sulfuri de fosfor importante din punct de vedere comercial și este un solid galben, dar atunci când nu este pur, culoarea compusului poate fi verzui sau gri. Molecula are o formă aproape identică cu cea a P 4 O 10 și se bazează pe o structură tetraedrică similară cu cea a adamantanului .
Sinteză
Prima sinteză a P 4 S 10 a fost descrisă în 1843 de Berzelius , [3] care a reacționat cu fosfor alb , P 4 , cu sulf la temperaturi peste 300 ° C. Aceeași procedură este încă valabilă. Alternativ, P 4 S 10 se poate forma prin reacția sulfului elementar sau a piritei , FeS 2 , cu ferofosfor, o formă impură de FeP 2 , un produs secundar al producției de P 4 din roci fosfatice :
- 4Fe 2 P + 18S → P 4 S 10 + 8FeS
- 4Fe 2 P + 18FeS 2 → P 4 S 10 + 26FeS
Reactivitate
P 4 S 10 este un compus stabil, dar reacționează în contact cu apa, acizi, baze și alcooli. În contact cu umiditatea atmosferică se hidrolizează pentru a forma hidrogen sulfurat , H 2 S, ceea ce dă P 4 S 10 un miros de ou putred. Acidul fosforic se formează și prin hidroliză:
- P 4 S 10 + 16H 2 O → 10H 2 S + 4H 3 PO 4
În contact cu apa reacționează violent eliberând acizi fosforici și H 2 S (toxici și inflamabili).
În chimia organică este utilizat ca agent de sulfurare. Reacțiile de acest tip necesită condiții de reflux în solvenți precum benzen , dioxan sau acetonitril , unde P 4 S 10 se disociază pentru a forma P 2 S 5 . Acesta din urmă poate fi prins de exemplu prin formarea unui complex cu piridină . Cetonele sunt transformate în tiocetonele . Atomul de oxigen poate fi înlocuit și cu sulf în esteri , imide și lactone . Tiamidele se obțin din amide . Tiofenul se obține din 1,4-dicetonele. În comparație cu reactivul Lawesson mai cunoscut, se obțin randamente mai mici cu P 4 S 10 . [4]
Utilizări
În 2006, peste 22.000 de tone de P 4 S 10 au fost produse numai în Statele Unite. [5] Compusul este utilizat în principal ca materie primă pentru a prepara aditivi lubrifianți , cum ar fi ditiofosfatul de zinc. Este, de asemenea, utilizat la producerea insecticidelor organofosfat , cum ar fi parathion și malathion . [6] Este, de asemenea, utilizat ca o componentă a unor electroliți solizi (de exemplu, Li 2 SP 2 S 5 ) în unele tipuri de baterii cu litiu. O utilizare minoră este ca agent de flotație .
Notă
- ^ Sigma-Aldrich; rev. din 19.09.2012
- ^ Depozitați sub o atmosferă de gaz inert.
- ^ Demselben, Ueber die Verbindungen des Phosphors mit Schwefel , în Justus Liebigs Annalen der Chemie , vol. 46, nr. 3, 1843, pp. 251-281, DOI : 10.1002 / jlac.18430460303 . Adus la 25 noiembrie 2010 .
- ^ T. Ozturk, E. Ertas și O. Mert, un reactiv Berzelius, decasulfură de fosfor (P4S10), în sinteze organice , în Chem. Rev., voi. 110, nr. 6, 2010, pp. 3419–3478, DOI : 10.1021 / cr900243d . Adus la 25 noiembrie 2010 .
- ^ Raport de actualizare a inventarului Agenției SUA pentru Protecția Mediului , la epa.gov . Adus la 25 noiembrie 2010 .
- ^ G. Bettermann, W. Krause, G. Riess, T. Hofmann, Compuși de fosfor, anorganici în Ullmann's Encyclopedia of Industrial Chemistry , Weinheim, Wiley-VCH, 2002, DOI : 10.1002 / 14356007.a19_527 .
Bibliografie
- NN Greenwood, A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe Pentasulfură de fosfor
Wikimedia Commons conține imagini sau alte fișiere pe Pentasulfură de fosfor