Tiofen
| Tiofen | |
|---|---|
| Numele IUPAC | |
| tiofen | |
| Denumiri alternative | |
| tiofurano tiaciclopentadienă | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 4 H 4 S |
| Masa moleculară ( u ) | 84,14 |
| Aspect | lichid incolor |
| numar CAS | |
| Numărul EINECS | 203-729-4 |
| PubChem | 8030 |
| ZÂMBETE | C1=CSC=C1 |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1,05 |
| Solubilitate în apă | nemiscibil cu apa, solubil în solvenți organici nepolari |
| Temperatură de topire | −38 ° C (235,15 K) |
| Temperatura de fierbere | 84 ° C (357,15 K) |
| Presiunea de vapori ( Pa ) la 293,15 K. | 80 hPa |
| Informații de siguranță | |
| Punct de flacără | −9 ° C (264,15 K) |
| Limite de explozie | 12,5% |
| Temperatură de autoaprindere | 395 ° C (668,15 K) |
| Simboluri de pericol chimic | |
  | |
| Pericol | |
| Fraze H | 225 - 302 - 319 - 412 |
| Sfaturi P | 210 - 260 - 262 - 273 - 305 + 351 + 338 - 403 + 235 [1] |
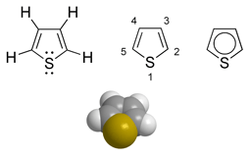
Tiofenul este un compus heterociclic aromatic format din patru atomi de carbon și unul de sulf legați într-o structură inelară penta-atomică. Furanul și pirolul sunt exemple obișnuite de analogi structurali în care atomul de sulf este înlocuit cu un atom de oxigen și respectiv un atom de azot legat de un hidrogen .
Tiofenul a fost descoperit inițial de Viktor Meyer în 1883 , ca un contaminant al benzenului. [2] Printre derivații săi demni de menționat se numără benzotiofenul , în care un inel benzenic este fuzionat cu tiofenul și dibenzotiofenul cu două inele benzenice condensate.
Proprietăți chimice
La temperatura camerei, tiofenul apare ca un lichid incolor cu un miros plăcut asemănător cu benzenul , un compus cu care împărtășește aromaticitatea și proprietățile chimice în consecință.
Tiofenul este un compus aromatic, chiar dacă calculele teoretice indică o aromaticitate mai mică decât cea a benzenului, deoarece 6 electroni sunt împărțiți prin orbitalii p ai celor cinci atomi ai inelului: unul din fiecare atom de carbon și doi din sulf , respectând astfel regula lui Hückel . Participarea unui dublet de sulf solitar la formarea norului aromatic π este fundamentală în determinarea caracterului aromatic al compusului. Ca o consecință a acestei caracteristici, tiofen este susceptibil la electrofilă atac la atomii de carbon ai ciclului, oferind tipic substituții electrofile aromatice , cum ar fi halogenare , nitrations și reacții Friedel-Crafts și sulfonations . În special, acesta din urmă este exploatat pentru al separa de benzen cu care este adesea găsit într - un amestec în ulei brut: prin tratarea unui benzen / tiofen amestec cu acid sulfuric , sulfonarea numai tiofen este obținut, a cărui derivat (un sulfonică acid ) este solubil în apă și poate fi separat prin extracția solventului . Separarea prin distilare simplă ar fi dificilă datorită diferenței mici de temperaturi de fierbere , care este de aproximativ 4 ° C. Tiofenul, deși (formal) un tioeter , nu este alchilat pe atomul de sulf de halogenuri de alchil , spre deosebire de tetrahidrotiofen , care este și un tioeter, care totuși nu este aromat.
Rezumat și surse
Tiofenul și derivații sunt obținuți clasic prin sinteza Paal-Knorr prin reacția 1,4- cetonelor cu agenți de sulfurizare precum reactivul Lawesson sau pentasulfura de fosfor ( formula moleculară P 4 S 10 ). Tiofenele specifice pot fi apoi sintetizate folosind reacția Gewald , care exploatează sulful elementar:
Tiofenul și derivații săi sunt prezenți în petrol , în concentrații cuprinse între 1-3% și pot fi obținuți și din cărbune . Acestea constituie produse nedorite și sunt eliminate prin procesul de hidrodesulfurare , cu divizarea în hidrocarburi și hidrogen sulfurat .
Utilizări
Tiofenii sunt compuși heterociclici importanți utilizați în sinteza medicamentelor și a produselor de protecție a plantelor . [3] Sunt utili și intermediarii sintetici , a căror reactivitate este exploatată în reacțiile care implică electrofili. Prin desulfurare cu nichel Raney se obțin butani 1,4-disubstituiți. Polimerizarea unităților monomer tiofen produce polietiofen , un material plastic care poate fi utilizat ca polimer conductor .
Tiofenul este, de asemenea, utilizat pentru denaturarea etanolului , un compus cu care formează un azeotrop .
Notă
- ^ foaie informativă tiofen despre IFA-GESTIS Arhivat 16 octombrie 2019 la Arhiva Internet .
- ^ Viktor Meyer, Ueber den Begleiter des Benzols im Steinkohlenteer , în Berichte der Deutschen chemischen Gesellschaft , vol. 16, 1883, pp. 1465–1478, DOI : 10.1002 / cber.188301601324 .
- ^ Jonathan Swanston „Thiophene” în Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006. DOI : 10.1002 / 14356007.a26 793.pub2 .
Elemente conexe
Alte proiecte
-
 Wikționarul conține dicționarul lema « tiofen »
Wikționarul conține dicționarul lema « tiofen » -
 Wikimedia Commons conține imagini sau alte fișiere despre tiofen
Wikimedia Commons conține imagini sau alte fișiere despre tiofen
linkuri externe
- ( EN ) Thiophene , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
| Controlul autorității | NDL ( EN , JA ) 00573066 |
|---|