Lămâie verde
Acest articol sau secțiune despre materialele în cauză nu citează sursele necesare sau cei prezenți sunt insuficienți . |
| Lămâie verde | |
|---|---|
| Caracteristici generale | |
| Compoziţie | oxid de calciu , hidroxid de calciu |
Termenul de var indică o serie de materiale de construcție , cunoscute din cele mai vechi timpuri, obținute prin arderea la o temperatură ridicată a calcarului , a marmurei , a cochiliilor sau a altor materiale care conțin carbonat de calciu , de o culoare gălbuie. [1]
Istorie
Deja romanii și fenicienii învățaseră mai întâi să folosească varul ca material de construcție , amestecat cu nisip pentru a forma mortar . Vitruvius , în lucrarea sa De architectura descrie producția pornind de la pietre albe, gătite în cuptoare ( calcar ) în care acestea pierd greutate (astăzi știm ca o consecință a eliberării de dioxid de carbon ). Materialul obținut, varul viu, a fost apoi „stins” aruncându-l în rezervoare pline cu apă .
Folosit inițial sub formă de „var aerian” (care se întărește numai dacă este în contact cu aerul ) a fost ulterior amestecat cu bucăți de lut copt (ceramică, cărămizi etc.) sau cu pozzolana , un nisip bogat în silice , care îi modifică caracteristicile rezistenței și impermeabilității, dar mai ales permit ca acesta să fie prins chiar și în medii care nu sunt în contact cu aerul (de obicei sub apă). Astfel s-au născut „mortarele hidraulice”, deși pe bază de var de aer.
În vremurile moderne, inginerii francezi ai școlii Ponts et Chaussées din 1750 au început să construiască bazele podurilor prin adăugarea de argilă la var și obținerea aceluiași var hidraulic care va fi studiat de englezul John Smeaton . Unele roci calcaroase (de exemplu, marne ) conțin impurități argiloase sau silicioase în interiorul lor; varul hidraulic poate fi obținut din aceste materiale fără a adăuga piese externe.
Pregătirea
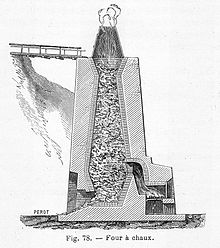
Materia primă pentru producerea de var este calcar , o rocă sedimentară bogată în carbonat de calciu (CaCO 3) , care este extras din cariere ; tipice sunt cele ale Dolomiților . Marmura și alte roci pot fi, de asemenea, utilizate în acest scop.
Materialul, zdrobit aproximativ cu un diametru al fragmentelor în ordinea centimetrilor sau chiar cu câțiva decimetri, este introdus în cuptoare sau cuptoare unde este încălzit treptat la 900-1100 ° C [2] și apoi iese din partea inferioară a cuptorul într-un interval de aproximativ zece ore. În această fază are loc o reacție chimică ( reacție de calcinare ) care duce la eliberarea de dioxid de carbon și la producerea de oxid de calciu sau var var:
După ardere, fragmentele de piatră își reduc greutatea cu aproximativ 40% din cauza atomilor de carbon și oxigen pierduți și capătă o consistență poroasă . În plus, culoarea gri comună a calcarului se pierde, iar pietrele devin în mare parte albe. Constituie var viu care, comercializat ca atare sau redus la pulbere, trebuie păstrat în recipiente perfect etanșe, deoarece este foarte higroscopic .
Pentru a obține var hidratat sau var stins, materialul trebuie să fie supus reacției de stingere:
asociat cu două efecte macroscopice evidente: o eliberare violentă de căldură și dezintegrarea pietrei datorită efectului expansiv al transformării din oxid în hidroxid de calciu .
Stingerea poate fi efectuată în două moduri diferite, prin stropire sau prin imersiune.
În primul caz, se utilizează un sistem de stingere relativ complex care implică: o primă zdrobire a oxidului în pietre de dimensiuni milimetrice, transferul fragmentelor pe o bandă transportoare pe care are loc stingerea efectivă, prin intermediul pulverizatoarelor care distribuie apa pe întreaga secțiune, astfel încât să se ude în mod uniform pietrele, care se rup în continuare din cauza reacției. După reacție, se obține o pulbere fină, numită pulbere de var hidratată care se împarte în funcție de finețe. De fapt, este posibilă comercializarea varului hidratat în două forme diferite ca floare de tei, de valoare și cost mai mare, cu tehnici restrictive specifice descrise de un standard UNI specific sau ca var de construcție, de valoare și finețe mai mici.
Stingerea prin imersiune, pe de altă parte, are loc atunci când mușchii de var rapid sunt aruncați într-un rezervor plin cu apă. În general, acest tip de stingere are loc în două etape, cu un prim rezervor de stingere și trecerea ulterioară în rezervoarele de condimentare, în interiorul căreia se formează pasta numită „chit de var” [3] . În rezervoarele de întărire este esențial să aveți o peliculă de apă la câțiva centimetri deasupra masei plastice, care garantează că hidroxidul de calciu nu va reacționa cu dioxidul de carbon din aer.
O altă metodă de producere a varului stins prevede obținerea pastei prin hidratarea ulterioară a varului hidratat în pulbere obținută din sistemul de stingere prin aspersoare. Această metodă de producție conduce la o brânză slăbită de calitate inferioară celei obținute prin imersiune și întărire îndelungată. Suspensia albă care „plutește” deasupra chitului este uneori vândută ca lapte de var. Varul hidraulic este preparat din rocă calcaroasă impură, care conține un anumit conținut, de la 6% la 22%, de argile sau alți hidrați de aluminosilicați.
Numele derivă din faptul că, spre deosebire de varul normal, este capabil să se întărească chiar și atunci când nu este în contact cu aerul.
Fenomenul calcinarolilor
Fenomenul calcinarolilor indică fenomenul, tipic varului aerian, care apare după „stingerea” varului CaO (oxid de calciu). Calcar (CaCO3) în timpul disociază de gătit , conform reacției :
adică se obține oxid de calciu (CaO, numit și var viu) și se eliberează dioxid de carbon (CO 2 ). Varul extras din cuptoare poate fi comercializat direct ca var rapid în bucăți. Cel mai adesea este transformat în hidrat ( var stins ) în funcție de reacția exotermă:
adică, prin adăugarea de apă (H2O) la oxidul de calciu este obținut (CaO), un dihydroxide de calciu (Ca (OH) 2, numit și var stins). Oprirea poate avea loc în două moduri:
- prin stropire: cu apă strict necesară reacției. Se utilizează apă atomizată și sub presiune, favorizând formarea unei pulberi (floare de tei), vândută în pungi, folosită pentru mortare și vopsele de tei .
- prin imersiune: cu exces de alimentare cu apă la reacție. Se numește „în ape mari” și se desfășoară la fața locului în căzi mari cu margine înaltă, pentru a evita accidentele, deoarece reacția este extrem de exotermă și producția de căldură este de natură să provoace fierberea apei. La sfârșitul acestei faze, înainte de evaporarea totală a apei, mulțimile sunt acoperite cu un strat de nisip. Varul stins astfel obținut se numește stins (alb, dens și gras) și nu poate fi utilizat înainte de cincisprezece zile pentru mortarele de zidărie și trei luni pentru mortarele de ipsos.
Cu toate acestea, se poate întâmpla ca unele bucăți de var rapid să se stingă după utilizare, producând, odată cu creșterea volumului, umflături și dezintegrări, adesea circulare. Acesta este fenomenul calcinarolilor și apare atunci când se utilizează var stins sau defect hidratat.
Odată ce varul hidratat a fost aplicat, în contact cu aerul apare reacția:
Acest proces se numește „reacție de stabilire și întărire”. Varul stins (Ca (OH) 2 ) în contact cu dioxidul de carbon (CO 2 ) reformează elementul inițial, calcarul (CaCO 3 ) și eliberează apă.
Carbonatarea
Setarea începe cu îndepărtarea apei și uscarea ulterioară. Acest lucru îl face inutilizabil pentru aplicații în contact cu apa (poduri, piloni), dar îl face preferabil betonului în cazul în care uscarea are loc rapid, cum ar fi aplicarea tencuielilor . De fapt, cimentul nu trebuie să se usuce înainte de terminarea fazei de prindere.
Odată ce varul s-a uscat, în contact cu dioxidul de carbon prezent în atmosferă , începe un proces lent care îl transformă în calcar ( carbonatare ), compusul original din care a fost produs. Reacția este:
Chiar dacă reacția anterioară este formal corectă, reacția reală este mai complexă. Observând reacția anterioară, de fapt, procesul ar părea să aibă loc între un Ca solid (OH) 2 și un gaz CO 2 , în timp ce în realitate reacția are loc în faza apoasă datorită apei de amestec cu var.
De fapt, hidroxidul de calciu se dizolvă în apă, datorită unei solubilități bune, dioxidul de carbon se dizolvă și în apă, formând o specie denumită acid carbonic H 2 CO 3 , din care o reacție acid-bazică formează o sare ușor solubilă sau calciu carbonat. Prin urmare, forma corectă este:
Reglarea și întărirea limelor aeriene
Setarea și întărirea loviturilor aeriene au loc în următoarele faze succesive:
- Evaporarea excesului de apă și uscarea aluatului;
- Cristalizarea Ca (OH) 2 cu consolidarea amestecului (stabilirea varului);
- Pornind de la exterior, carbonatarea (formarea de CaCO 3 cristale) începe între granule de nisip sau între materialele pe care legătura mortar trebuie ( călire ). La final totul devine un corp solid compact și insolubil în apă.
Forme chimice
Varul se prezintă în două forme distincte din punct de vedere chimic :
- Varul viu: constituit chimic din oxid de calciu , CaO, puternic higroscopic ;
- Var variat sau hidratat: constituit chimic din hidroxid de calciu , Ca (OH) 2 .
Cedați la grassello
Randamentul plăcii unui var este definit ca raportul dintre volumul varului stins [3] atunci când, datorită evaporării unei părți din excesul de apă, începe să crape la suprafață și greutatea varului viu care a generat aceasta.
Randamentul sacrificat este exprimat în metri cubi pe tonă.
Lovituri grase și slabe
Se spune că un var este gras atunci când are un randament de var stins ≥ 2,5, în timp ce vorbim de var slab pentru valori mai mici de 2,5, dar mai mari de 1,5.
Clasificare
În sensul legislației actuale, loviturile aeriene sunt împărțite în:
- var de grăsime în bulgări;
- var slab în bulgări;
- pulbere de var hidratată, care include două tipuri de produse:
- floare de tei;
- var hidratat pentru constructii.
Angajamente
Quicklime este folosit:
- pentru păsări de curte, pentru a crește calciul prezent în coajă;
- pentru tratarea apei , pentru a-i reduce aciditatea ;
- în purificare , pentru îndepărtarea fosfaților și a altor impurități (floculante) și pentru desulfurarea gazelor de eșapament ;
- în fabricarea hârtiei , pentru a dizolva fibrele de lemn ;
- ca înălbitor și albitor ;
- pentru dezinfectarea mediilor;
- în agricultură , pentru corectarea acidității solului;
- în chimie , pentru a purifica acidul citric și glucoza , ca desicant și absorbant al dioxidului de carbon ;
- pentru stabilizarea solurilor argiloase în fundațiile și terasamentele drumurilor.
Se utilizează var stins:
- ca material de construcție combinat cu nisip ( decantare );
- ca produs de finisare natural, cum ar fi marmorino, var neted ( intonachino ), vopsea de var folosită pentru decorarea pereților interni și externi;
- ca acoperire de perete impermeabilă utilizată atât în interior, cât și în exterior ( Tadelakt );
- amestecat cu ciment pentru a produce un mortar de plastic potrivit pentru tencuieli ;
- în bronzarea pieilor ;
- în industria petrochimică , să producă aditivi pentru lubrifianți ;
- pentru producerea stearatului de calciu ;
- pentru neutralizarea și absorbția poluanților ;
- pentru tratarea apei utilizate în industria alimentară ;
- pentru a corecta aciditatea solului;
- în agricultură, combinat cu sulfat de cupru , ca fungicid ( amestec Bordeaux );
- în industria farmaceutică pentru prepararea sărurilor de calciu și magneziu ;
- în stomatologie ca medicament în substraturi și în endodonție .
Siguranță
Varul, în special varul viu, are o puternică alcalinitate și causticitate . Contactul cu pielea oxidului anhidru poate provoca arsuri grave, așa cum se întâmplă cu soda caustică . Contactul cu puțină apă (insuficient pentru a absorbi căldura produsă) poate provoca o fierbere violentă și proiecția stropilor caustice și fierbinți. Din aceste motive, este important să folosiți o salopetă impermeabilă, mănuși de calitate și ochelari de protecție atunci când manipulați var, atât solid, cât și în soluție, și mortar de var.
Ingerarea hidroxidului de calciu poate provoca simptome severe, inclusiv dificultăți de respirație, sângerări gastro-intestinale, hipotensiune și modificări periculoase ale pH-ului sângelui .
Notă
- ^ Var. În: Angela Weyer și colab. (editat de), EwaGlos, Glosar european ilustrat de termeni de conservare pentru picturi de perete și suprafețe arhitecturale. Definiții în engleză cu traduceri în bulgară, croată, franceză, germană, maghiară, italiană, poloneză, română, spaniolă și turcă , Petersberg, Michael Imhof, 2015, p. 383.
- ^ "Calce stins" În: Mara Nimmo (editat de), Pictură murală. Propunere de glosar , 2001, p. 28.
- ^ a b Chitul de var este o suspensie în apă de hidroxid de calciu (var stins). Se formează în timpul operațiilor de stingere a varului rapid și apare ca o masă plastică grasă la atingere.
Elemente conexe
Alte proiecte
-
 Wikționarul conține dicționarul lema « var »
Wikționarul conține dicționarul lema « var » -
 Wikimedia Commons conține imagini sau alte fișiere pe var
Wikimedia Commons conține imagini sau alte fișiere pe var
| Controlul autorității | Thesaurus BNCF 27984 · LCCN (RO) sh85077003 · NDL (RO, JA) 00570622 |
|---|