Oxid de trifenilfosfină
| Oxid de trifenilfosfină | |
|---|---|
| Numele IUPAC | |
| Trifenil-λ 5- fosfanona | |
| Denumiri alternative | |
| oxid de trifenilfosfină | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 18 H 15 OP |
| Aspect | solid |
| numar CAS | |
| Numărul EINECS | 212-338-8 |
| PubChem | 13097 |
| ZÂMBETE | C1=CC=C(C=C1)P(=O)(C2=CC=CC=C2)C3=CC=CC=C3 |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1.2 [1] |
| Solubilitate în apă | ușor solubil |
| Temperatură de topire | 155–158 ° C (428–431 K) [1] |
| Temperatura de fierbere | > 360 ° C (633 K) [1] |
| Proprietăți termochimice | |
| C 0 p, m (J K −1 mol −1 ) | 312,5 [2] |
| Informații de siguranță | |
| Punct de flacără | 180 ° [1] |
| Simboluri de pericol chimic | |
 | |
| Fraze H | 302 - 412 [1] |
| Sfaturi P | 273 [1] |
Oxidul de trifenilfosfină este compusul organofosforic cu formula OP (C 6 H 5 ) 3 , scris de obicei ca OPPh 3 sau Ph 3 PO . Disponibil comercial, în condiții normale, este un solid cristalin incolor, slab solubil în apă, dar solubil în solvenți organici polari. În general, se obține ca produs final deșeu în numeroase reacții organice care implică trifenilfosfină . [3] Este utilizat ca reactiv pentru a facilita cristalizarea compușilor chimici. [4]
Structura
OPPh 3 este o moleculă tetraedrică , cu atomul de fosfor în poziție centrală. [5] [6] Din punct de vedere cristalografic, se cunosc mai multe polimorfe. [7] [8] [9] [10] Cele mai cunoscute sunt:
- o structură monoclinică, grup spațial P2 1 / c, cu constante de rețea a = 1 506 , ora 18 , b = 903,7 um , c = 1 129,6 pm , β = 98,47 ° și patru unități de formulă pe unitate de celulă , distanțele P - O 148.4 pm și P - C 180 pm . [9]
- o structură ortorombică, grup spațial Pbca, cu constante de rețea a = 2 908 , 21:00 , b = 913.47 pm , c = 1 126 , 13 , patru unități de formulă pe unitate de celulă , distanțe P - O 147.9 pm și P - C 180 pm . [10]
Sinteză
Oxidul de trifenilfosfină a fost obținut pentru prima dată de August Michaelis în 1882. [11] Legătura P = O este foarte puternică și, în consecință, compusul este ușor de obținut din trifenilfosfină prin tratarea acestuia cu diverși oxidanți, cum ar fi acidul azotic , dioxidul de mangan , permanganatul de potasiu , hidrogenul. peroxid și chiar cu oxigen atmosferic simplu. [3] [5] [6] Din acest motiv, probele de trifenilfosfină rămase în aer sunt contaminate de OPPh 3 .
Reactivitate
Oxidul de trifenilfosfină este un compus foarte stabil. Rigiditatea moleculei și basicitatea relativă a atomului de oxigen înseamnă că OPPh 3 este utilizat în mod obișnuit pentru cristalizarea moleculelor care altfel sunt greu de obținut cristale. Acest lucru se datorează faptului că OPPh 3 este un bun acceptor de protoni și formează complexe cu numeroase substanțe organice care au protoni acizi. [4]
Ca produs secundar în chimia organică
În chimia organică OPPh 3 se formează în cantități stoichiometrice ca produs secundar în multe reacții, inclusiv reacțiile Wittig , Staudinger și Mitsunobu . Separarea subprodusului OPPh 3 de amestecul de reacție poate fi dificilă în diferite cazuri. Dacă produsul dorit este ușor solubil în solvenți precum hexan sau dietil eter , o bună separare se poate realiza prin simpla triturare în acești solvenți, unde OPPh 3 este insolubil. O altă posibilitate este utilizarea Mg (II) care cu OPPh 3 formează un complex insolubil în toluen sau diclormetan , care poate fi separat prin filtrare. [12] în solvenți polari , cum ar fi etanolul , acetat de etil și tetrahidrofuran adăugarea de ZnCl2 provoacă precipitarea unui complex insolubil care poate fi filtrat. [13] De asemenea, au fost cercetate diverse metode pentru recuperarea deșeurilor OPPh 3 prin regenerarea trifenilfosfinei. Există diferiți agenți de dezoxigenare, cum ar fi fosgenul și triclorosilanul . [14]
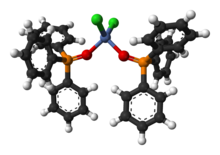
Ca liant în chimia coordonării
OPPh 3 poate acționa ca un liant și preferă să se coordoneze cu ioni metalici clasificați ca duri conform teoriei HSAB . Un exemplu este complexul tetraedric NiCl 2 (OPPh 3 ) 2 . [15]
Notă
- ^ a b c d e f GESTIS 2020
- ^ Lide 2005
- ^ a b Engel și Cohen 2006
- ^ a b Etter și Baures 1988
- ^ a b Corbridge 1995
- ^ a b Holleman și Wiberg 2007
- ^ Bandoli și colab. 1970
- ^ Ruban și Zabel 1976
- ^ a b Spek 1987
- ^ a b Al-Farhan 1992
- ^ Michaelis și Gleichmann 1882
- ^ Isola și colab. 2000
- ^ Batesky și colab. 2017
- ^ van Kalkerenet și colab. 2013
- ^ Goodgame și Goodgame 1965
Bibliografie
- ( EN ) KA Al-Farhan, Structura cristalină a oxidului de trifenilfosfină , în Journal of Crystallographic and Spectroscopic Research , vol. 22, 1992, pp. 687–689, DOI : 10.1007 / BF01160986 .
- ( EN ) G. Bandoli, G. Bortolozzo, DA Clemente, U. Croatto și C. Panattoni, Structura cristalină și moleculară a oxidului de trifenilfosfină , în J. Chem. Soc. A , nu. 0, 1970, pp. 2778-2780, DOI : 10.1039 / J19700002778 .
- ( EN ) DC Batesky, MJ Goldfogel și DJ Weix, îndepărtarea oxidului de trifenilfosfină prin precipitare cu clorură de zinc în solvenți polari , în J. Org. Chem. , vol. 82, nr. 19, 2017, pp. 9931-9936, DOI : 10.1021 / acs.joc.7b00459 .
- ( EN ) DEC Corbridge, Fosfor: Un contur al chimiei, biochimiei și tehnologiei sale , ediția a V-a, Amsterdam, Elsevier, 1995, ISBN 0-444-89307-5 .
- ( EN ) R. Engel și JI Cohen, Phosphorus: Organophosphorus Chemistry , în Encyclopedia of Inorganic Chemistry , ediția a II-a, John Wiley & Sons, 2006, DOI : 10.1002 / 0470862106.ia187 , ISBN 9780470862100 .
- ( EN ) MC Etter și PW Baures, oxid de trifenilfosfină ca ajutor pentru cristalizare , în J. Am. Chem. Soc. , Vol. 110, nr. 2, 1988, pp. 639-640, DOI : 10.1021 / ja00210a076 .
- GESTIS, oxid de trifenilfosfină , pe gestis-en.itrust.de . Adus pe 19 martie 2020 . Pagina de oxid de trifenilfosfină din baza de date GESTIS.
- ( EN ) DML Goodgame și M. Goodgame, Spectre aproape infraroșii ale unor complexe pseudotetraedrice de cobalt (II) și nichel (II) , în Inorg. Chem. , vol. 4, nr. 2, 1965, pp. 139–143, DOI : 10.1021 / ic50024a002 .
- ( DE ) AF Holleman și N. Wiberg, Lehrbuch der Anorganischen Chemie , Berlin, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1 .
- ( EN ) AM Isola, NJ Holman, GB Tometzki, JP Watts și alții, proces complex de oxid de trifenilfosfină , în brevetul SUA 6011181A , 2000.
- DR Lide (Editor), CRC Handbook of Chemistry and Physics, Internet Version 2005 , at hbcponline.com , CRC Press, Boca Raton, 2005. Accesat la 9 decembrie 2017 .
- ( DE ) A. Michaelis și L. Gleichmann, Ueber Di- und Triphenylphosphin , în Ber. Deutsch. Chem. Iisus , vol. 15, nr. 1, 1882, pp. 801-804, DOI : 10.1002 / cber.188201501170 .
- ( EN ) G. Ruban și V. Zabel, Cryst. Struct. Comun. , vol. 5, 1976, pp. 671-677.
- ( EN ) AL Spek, Structura unui al doilea polimorf monoclinic al oxidului de trifenilfosfină , în Acta Cryst. , C43, 1987, pp. 1233-1235, DOI : 10.1107 / S0108270187092345 .
- (EN) HA van Kalkeren, FL van Delft și FPJT Rutjes, Cataliză organofosforică pentru a ocoli deșeurile de oxid de fosfină , în chemsuschem. , vol. 6, nr. 9, 2013, pp. 1615-1624, DOI : 10.1002 / cssc.201300368 .