Clorură de cromil
| Clorură de cromil | |
|---|---|
| Numele IUPAC | |
| Dioxid de diclorură de crom (VI) | |
| Denumiri alternative | |
| Clorură de cromil Oxiclorură de crom | |
| Caracteristici generale | |
| Formula moleculară sau brută | CrO 2 Cl 2 |
| Masa moleculară ( u ) | 154,8 g / mol |
| Aspect | lichid roșu purpuriu |
| numar CAS | |
| Numărul EINECS | 239-056-8 |
| PubChem | 22150757 |
| ZÂMBETE | Cl[Cr](Cl)(=O)=O |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1,91 g / cm³ |
| Solubilitate în apă | se descompune |
| Temperatură de topire | -96,5 ° C |
| Temperatura de fierbere | 117 ° C |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
    | |
| Fraze H | 271 - 314 - 317 - 340 - 350i - 410 |
| Sfaturi P | 201 - 210 - 273 - 280 -305 + 361 + 353 - 305 + 351 + 338 [1] |
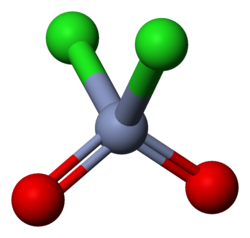
Clorură de cromil este un compus anorganic cu formula CrO 2Cl 2. Este oxiclorură de Cr (VI), configurație electronică d 0 , diamagnetică . Molecula are o formă tetraedrică distorsionată, cu atomul de Cr 3 hibridizat sp, ca S în clorura de sulfuril (SO 2 Cl 2 ), un compus cu care poate fi comparat. Apare ca un lichid roșu sângele cu miros înțepător, care la expunerea la aer reacționează cu umiditatea prezentă prin hidrolizarea la anhidridă cromică (sau acid cromic ) producând vapori de acid clorhidric . Este un compus foarte oxidant și nu este foarte discriminator în acțiunea sa și, prin urmare, nu este foarte util ca atare [2] ; este mai oxidant [2] decât compușii analogi ai molibdenului și tungstenului (solidele galbene pal); ca toți compușii Cr (VI), este toxic și cancerigen [3] . Reacționează cu majoritatea compușilor organici dând reacții violente și chiar cu hidrocarburi nu oferă soluții stabile. Este solubil în hidrocarburi clorurate , cum ar fi CH 2Cl 2 , CHCI3 și CCI4 , în care este posibil să - l folosească la rece.
Sinteză
Acesta poate fi preparat prin reacția dintre HCl și CrC 3 sau între o soluție concentrată de acid clorhidric și cromat de potasiu , urmată de adăugarea de acid sulfuric ca agent de deshidratare. Clorura de cromil produsă ( d = 1,92 g / ml, mai mare decât acidul sulfuric) se va colecta în partea de jos și poate fi colectată cu o pipetă de sticlă [4] .
Cu toate acestea, o reacție mai simplă de efectuat în laborator este adăugarea excesului de H 2 SO 4 concentrat la un amestec de clorură alcalină ( KCl sau NaCl ) și un cromat sau dicromat ( K 2 CrO 4 sau K 2 Cr 2 O 7 ) :
Acid sulfuric trebuie adăugat în exces pentru a absorbi apa produsă în reacție, astfel încât să nu reacționeze cu CrO 2 Cl 2 (reformând cromatul).
Proprietăți chimice
Clorura de cromil are un puternic caracter electrofil și puternice proprietăți oxidante. Oxidează hidrocarburile și sulful solid la temperatura camerei dând reacții puternic exoterme. Reacționează cu apa care degajă acidul clorhidric și vaporii de anhidridă cromică:
Angajamente
Este utilizat în unele reacții organice, de exemplu oxidarea toluenului la benzaldehidă . [5] Cu toate acestea, reacțiile cu compuși organici trebuie efectuate în condiții bine controlate, deoarece CrO 2 Cl 2 reacționează violent cu compușii organici, uneori provocând arderea instantanee.
Notă
- ^ Foaie de clorură de cromil pe IFA-GESTIS , pe gestis-en.itrust.de . Adus la 18 iunie 2021 (Arhivat din original la 16 octombrie 2019) .
- ^ a b NN Greenwood și A. Earnshaw, Chimia elementelor , ediția a II-a, Butterworth-Heinemann, 1997, pp. 1022-3, ISBN 9780750633659 .
- ^ (EN) PubChem, Banca de date privind substanțele periculoase (HSDB): 518 , pe pubchem.ncbi.nlm.nih.gov. Adus la 17 august 2020 .
- ^ HH Sisler, Chromyl Chloride , in Inorganic Synthesis , Vol. 2, New York, McGraw-Hill, 1946, pp. 205-7.
- ^ Pradyot Patnaik. op. cit.
Bibliografie
- G. Salomone - Prepararea substanțelor chimice anorganice
- Pradyot Patnaik. Manual de produse chimice anorganice . McGraw-Hill, 2002, ISBN 0-07-049439-8
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre clorură de cromil
Wikimedia Commons conține imagini sau alte fișiere despre clorură de cromil
linkuri externe
- Sinteza de clorură de crom cromil și pentoxid - YouTube