Trietilaluminiu
| Trietilaluminiu | |
|---|---|
| Numele IUPAC | |
| Trielilaluminiu | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 12 H 30 Al 2 |
| Masa moleculară ( u ) | 228,33 |
| Aspect | lichid incolor |
| numar CAS | |
| Numărul EINECS | 202-619-3 |
| PubChem | 16682930 |
| ZÂMBETE | CC[Al](CC)CC |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 0,835 |
| Solubilitate în apă | reacție violentă |
| Temperatură de topire | -50 ° C (223 K) |
| Temperatura de fierbere | 128-130 ° C (401-403 K) la 50 mmHg |
| Informații de siguranță | |
| Punct de flacără | −18 ° C (255 K) |
| Simboluri de pericol chimic | |
| | |
| Expresii R. | 14-17-34 |
| Fraze S. | 16-43-45 |
Trietilaluminiu este un compus organometalic din aluminiu , de obicei prescurtat ca TEA . În condiții normale apare ca un lichid incolor; este piroforic (se aprinde imediat la contactul cu aerul) și reacționează violent cu apa, eliberând gaze inflamabile. Se depozitează în recipiente din oțel inoxidabil sau sub formă de lichid pur sau într-o soluție de solvenți de hidrocarburi precum hexan , heptan sau toluen . TEA este utilizat în multe procese industriale, în special pentru producția de polietilenă și alcooli cu lanț drept. Sute de mii de tone sunt consumate în fiecare an. [1]
Structura
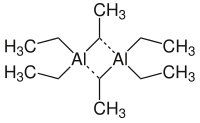
În soluție și în stare solidă, compusul are o structură dimerică cu formula Al 2 Et 6 , unde Et este abrevierea grupării etil , –CH 2 CH 3 . Două grupări etil acționează ca liganzi de punte și patru sunt terminale. Cei doi atomi de carbon punți sunt pentacoordinați. Tipul de legătură seamănă cu cel al diboranului și implică legături cu trei centri și doi electroni . La fel ca trimetilaluminiu , TEA este, de asemenea, o moleculă de flux, cu un schimb rapid între grupările etil terminale și punte. La temperaturi mai ridicate în faza gazoasă, sunt prezente unități monomer AlEt 3 . [2]
Sinteză
TEA poate fi preparat cu diferite procese. Descoperirea unei sinteze eficiente a fost importantă pentru aplicațiile industriale care utilizează TEA. Cel mai utilizat proces necesită mai multe etape și poate fi rezumat cu reacția: [1]
- 2Al + 3H 2 + 6C 2 H 4 → Al 2 Et 6
Deoarece această sinteză este foarte eficientă, TEA este unul dintre cei mai ușor disponibili compuși organometalici ai aluminiului.
TEA poate fi obținut de la triclorură trietilaluminiu, Al 2 CI 3 Et 3, care se obține prin tratarea pulberii de aluminiu cu cloretan , C 2 H 5 Cl. TEA se obține prin reducerea triclorurii de trietilaluminiu cu un metal alcalin, cum ar fi sodiul : [1]
- 3Al 2 Cl 3 Et 3 + 9Na → 2Al 2 Et 6 + 2Al + 9NaCl
Reactivitate
Legătura Al-C este polarizată și, prin urmare, TEA reacționează rapid și violent cu substanțe protice precum acizi minerali , apă, amoniac , mercaptani , fenoli . Reacția duce la eliberarea de etan : [3]
- Al 2 Et 6 + 6HX → 2Al 2 X 6 + 6EtH
Chiar și acizii slabi, cum ar fi acetilenele monosubstituite și alcoolii, sunt suficienți pentru această reacție. [1]
Cu oxigenul atmosferic, TEA se aprinde spontan, deoarece reacția este radicală și foarte exotermă. Dacă este efectuată într-un mod controlat, reacția duce la alcoxizi : [1]
- Al 2 Et 6 + 3O 2 → 2Al (OEt) 3
În TEA legătura dintre cele două centre de aluminiu este relativ slabă și poate fi ruptă de baze (L) pentru a forma aducti cu formula LAlEt 3 ; în acești compuși centrul de aluminiu este coordonat cu geometria tetraedrică . [4]
- Al 2 Et 6 + 2L → 2LAlEt 3
Aplicații
Cea mai importantă aplicație economică a TEA este utilizarea sa ca co-catalizator în catalizatori Ziegler-Natta pentru producția de poliolefine, în special polietilenă și polipropilenă . TEA are funcția de a reduce un complex metalic, de obicei pe bază de titan, formând specia activă catalitic; în consecință, această aplicație consumă o parte relativ mică din producția mondială de TEA. [1]
Cea mai mare parte a TEA este consumată în procese necatalitice, în principal pentru a obține alcooli primari liniari. Inițial, TEA este utilizat pentru oligomerizarea etilenei și obținerea unui amestec de compuși "trialchilaluminiu", simplificat aici cu gruparea octil:
- Al 2 (C 2 H 5 ) 6 + 18C 2 H 4 → Al 2 (C 8 H 17 ) 6
Ulterior, compușii trilachilici sunt oxidați în alcoxizi cu oxigen și apoi hidrolizați:
- Al 2 (C 8 H 17 ) 6 + 3 / 2O 2 → Al 2 (OC 8 H 17 ) 6
- Al 2 (OC 8 H 17 ) 6 + 3 / 2H 2 O → 6C 8 H 17 OH + 2 "Al (OH) 3 "
Alcoolii liniari obținuți sunt apoi folosiți în producția de copolimeri , detergenți și lubrifianți . [1]
Ca agent piroforic
TEA se aprinde la contactul cu aerul și se descompune prin aprinderea cu apă și alți oxidanți. [5] Este una dintre puținele substanțe suficient de piroforice pentru a se aprinde în contact cu oxigenul lichid . Aceste proprietăți piroforice îl fac interesant pentru aprinderea motoarelor rachete . Ar putea fi folosit și ca propulsor lichid , dar nu a fost utilizat în niciun mediu care a intrat în producție. [6] Lansatorul Falcon 9 produs de SpaceX folosește un amestec TEA- trietilboran pentru a aprinde prima etapă. [7]
TEA amestecat cu agent de îngroșare poliizobutilenă a fost, de asemenea, folosit ca armă incendiară, alternativ cu napalm , în lansatoarele de grenade M202 . [8]
Siguranță
TEA este un compus periculos, care trebuie tratat foarte atent. Trebuie depozitat și utilizat într-o atmosferă inertă, deoarece se aprinde spontan în aer. Reacționează violent cu apa, eliberând etan (inflamabil). În caz de contact, provoacă arsuri severe ale pielii și membranelor mucoase și leziuni oculare grave. Nu există date care să indice proprietăți cancerigene. Este considerat nu foarte periculos pentru mediu. [5]
Notă
- ^ a b c d e f g Krause și colab. 2002
- ^ Vass și colab. 2002
- ^ Elschenbroich 2006
- ^ Housecroft și Sharpe 2008
- ^ a b Alfa Aesar, Fișa cu date de securitate trietilaluminiu ( PDF ) [ link rupt ] , pe alfa.com . Adus la 17 octombrie 2011 .
- ^ Clark 1972
- ^ Spaceflight Now, Mission Status Center, 2 iunie 2010, 1905 GMT , pe spaceflightnow.com . Adus la 17 octombrie 2011 .
- ^ M202A1 Flame Assault Shoulder Weapon , la inetres.com . Adus la 17 octombrie 2011 .
Bibliografie
- ( EN ) JD Clark, Ignition! O istorie informală a propulsorilor de rachete lichide , New Brunswick, NJ, Rutgers University Press, 1972.
- ( EN ) Christoph Elschenbroich, Organometallics , Weinheim, Wiley-VCH, 2006, ISBN 978-3-527-29390-2 .
- ( EN ) CE Housecroft, AG Sharpe, Chimie anorganică , ediția a 3-a, Harlow (Anglia), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6 .
- ( EN ) MJ Krause, F. Orlandi, AT Saurage, JR Zietz Jr., Compuși de aluminiu, organici , în Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, 2002, DOI : 10.1002 / 14356007.a01_543 .
- ( EN ) G. Vass, G. Tarczay, G. Magyarfalvi, A. Bödi, L. Szepes, HeI Photoelectron Spectroscopy of Trialkylaluminum and Dialkylaluminum Hydride Compounds and Their Oligomers , in Organometallics , vol. 21, n. 13, 2002, pp. 2751-2757, DOI : 10.1021 / om010994h .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe Triethylaluminium
Wikimedia Commons conține imagini sau alte fișiere pe Triethylaluminium
linkuri externe
- ( EN ) Triethylaluminium , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.