Iodură de aluminiu
| Iodură de aluminiu | |
|---|---|
| Denumiri alternative | |
| iodură de aluminiu (III) | |
| Caracteristici generale | |
| Formula moleculară sau brută | AlI 3 |
| Masa moleculară ( u ) | 407,695 |
| Aspect | solid incolor |
| numar CAS | |
| Numărul EINECS | 232-054-8 |
| PubChem | 82222 |
| ZÂMBETE | [Al](I)(I)I |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 3,98 |
| Solubilitate în apă | reacție violentă |
| Temperatură de topire | 191 ° C (464 K) |
| Temperatura de fierbere | 360 ° C (633 K) |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | 310 |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
 | |
| Fraze H | 314 |
| Sfaturi P | 260, 301 + 330 + 331, 303 + 361 + 353, 305 + 351 + 338, 405, 501 |
Iodură de aluminiu (sau , de asemenea , triiodură de aluminiu în conformitate cu standardele IUPAC) este compus anorganic cu formula aLi 3. În condiții normale, este un solid incolor format din dimeri de Al 2 I 6 . Se hidrolizează rapid în apă eliberând iodură de hidrogen. În acest compus, aluminiul este în starea de oxidare +3. Este mai puțin frecvent utilizat decât clorura corespunzătoare ( AICI3 ), și este folosit ca un catalizator în unele reacții de sinteză organică .
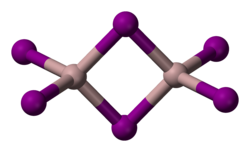
Structură și proprietăți
3 este un Alī compus molecular care există doar ca un dimer Al 2 I 6 în ambele stări solide și lichide și gazoase. În Al 2 I 6 atomii de aluminiu au coordonare tetraedrică. [1] Distanțele Al - I sunt 258 pm pentru iodurile în punte și 253 pm pentru cele terminale. [2]
Sinteză
AlI 3 este preparat prin sinteză directă între aluminiu și iod într-o atmosferă inertă: [3]
- 2Al + 3I 2 → Al 2 I 6
Reactivitate
La fel ca alte halogenuri de aluminiu, AlI 3 este sensibil la umiditate și se descompune la încălzirea în aer pentru a forma iod și oxid de aluminiu . [3] Reacționează violent cu apa pentru a forma iodură de hidrogen. Este un acid Lewis puternic.
Utilizare
Iodura de aluminiu este mult mai puțin utilizată decât clorura de aluminiu corespunzătoare. AlI 3 este utilizat în sinteza organică ca catalizator pentru a activa unele tipuri de legături S - O și N - O. Descompune aril eterii și dezoxigenează epoxizii . [4] Poate fi folosit pentru a prepara alți compuși organici iodați. [5]
Informații de siguranță
AlI 3 este disponibil comercial. Este un compus coroziv care la contact provoacă arsuri grave ale pielii și leziuni oculare severe. Este iritant pentru căile respiratorii. Nu există date care să indice proprietăți cancerigene. Nu este considerat foarte periculos pentru apă și mediu. [6]
Notă
- ^ Greenwood și Earnshaw (1997)
- ^ Apblett 2006
- ^ a b Brauer 1963 , p. 814 .
- ^ Gugelchuk 2001
- ^ Lee și colab. 2007
- ^ Alfa Aesar, fișa cu date de securitate AlI 3 .
Bibliografie
- ( EN ) AW Apblett, Aluminium: chimie anorganică , în Enciclopedia chimiei anorganice , ediția a doua, John Wiley & Sons, 2006, DOI : 10.1002 / 0470862106.ia007 , ISBN 978-0-470-86210-0 .
- ( EN ) G. Brauer, Handbook of preparative anorganic chemistry, Vol. 1 , ed. A II-a, New York, Academic Press, 1963.
- ( EN ) NN Greenwood și A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ( EN ) M. Gugelchuk, Iodură de aluminiu , în L. Paquette (eds), Enciclopedia reactivilor pentru sinteza organică , New York, J. Wiley & Sons, 2001, DOI : 10.1002 / 047084289X.ra083 .
- SI Lee, G.-S. Hwang și DH Ryu, iodura de aluminiu au promovat sinteza foarte stereoselectivă Z a esterilor β-Iodo Morita-Baylis-Hillman cu cetone ca acceptori de aldol , în Synlett. , Nu. 1, 2007, pp. 59-62, DOI : 10.1055 / s-2006-958421 . Adus la 24 mai 2012 .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe iodură de aluminiu
Wikimedia Commons conține imagini sau alte fișiere pe iodură de aluminiu