Iodometan
| Iodometan | |
|---|---|
| Numele IUPAC | |
| iodometan | |
| Denumiri alternative | |
| iodură de metil | |
| Caracteristici generale | |
| Formula moleculară sau brută | CH 3 I |
| Masa moleculară ( u ) | 141,94 |
| Aspect | lichid incolor cu miros acru |
| numar CAS | |
| Numărul EINECS | 200-819-5 |
| PubChem | 6328 |
| ZÂMBETE | CI |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 2.28 |
| Indicele de refracție | 1.531 |
| Solubilitate în apă | 14 g / L (20 ° C) |
| Temperatură de topire | −66,5 ° C (206,65 K) |
| Temperatura de fierbere | 42,5 ° C (315,65 K) |
| Presiunea de vapori ( Pa ) la 293,15 K. | 50.000 |
| Proprietăți toxicologice | |
| LD 50 (mg / kg) | 76 (oral, șobolan) |
| Informații de siguranță | |
| Punct de flacără | −28 ° C (245,15 K) |
| Simboluri de pericol chimic | |
  | |
| Pericol | |
| Fraze H | 301-312 - 315-331 - 335-351 |
| Sfaturi P | 261 - 280 - 301 + 310 - 311 [1] |
Iodometanul, numit și iodură de metil, este un compus chimic obținut prin înlocuirea unui atom de hidrogen de metan cu un iod . La temperatura camerei este prezentat ca un lichid incolor miscibil în solvenți organici . În natură este emis în cantități mici din plantațiile de orez . [2] Este utilizat în sinteza organică ca agent de metilare și se propune utilizarea în agricultură ca agent fumigant care înlocuiește bromometanul , [3] interzis de Protocolul de la Montreal .
Sinteză
Iodometanul este sintetizat prin reacția metanolului cu triiodura de fosfor , obținută in situ folosind iod și roșu fosfor : [4]
O metodă de sinteză alternativă exploatează reacția dintre sulfatul de dimetil și iodura de potasiu în prezența carbonatului de calciu : [4]
Iodometanul poate fi purificat prin distilare și spălare ulterioară cu tiosulfat de sodiu pentru a elimina urmele de iod.
O altă metodă de sinteză care utilizează metanol și iodură de potasiu în prezența acidului sulfuric :
Reacția se desfășoară la temperatură scăzută și „ apa produsă este absorbită de un exces de acid sulfuric, mutând astfel„ echilibrul spre dreapta. Iodometanul obținut poate fi distilat din amestecul de reacție.
Reacții
Iodometanul este un substrat excelent pentru reacțiile S N 2 , împiedicat steric și puțin cu iod, care este un grup bun de părăsire . Se folosește pentru alchilarea nucleofililor care conțin atomi de carbon, oxigen, sulf, azot și fosfor. [5] De exemplu, poate fi utilizat pentru metilarea fenolilor și a acizilor carboxilici : [6]
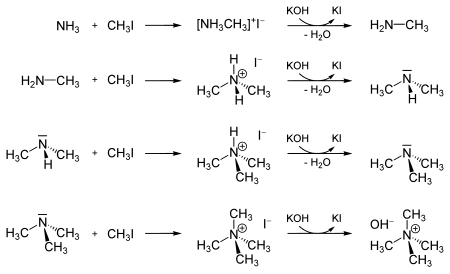
Un alt exemplu este reprezentat de metilarea „ amoniacului , cu formarea derivaților aminelor (ioduri metilamoniu):
Iodometanul poate fi utilizat ca precursor al reactivului Grignard CH 3 MgI, a cărui utilizare a fost oarecum înlocuită de metilitiu disponibil comercial.
În procesul Monsanto , iodura de metil se formează in situ prin reacția dintre metanol și iodură de hidrogen . Apoi , CH 3 I reacționează cu monoxid de carbon în prezența unui complex de rodiu care formează ch3 COI ( iodură de acetil ), care după hidroliză produce acid acetic .
Toxicitate
Iodometanul are un LD50 pentru administrare orală la șobolani de 76 mg / kg, iar în ficat se transformă rapid în S-metil glutation . [7] Este clasificat ca potențial cancerigen de către diferite agenții active în domeniile medical și de mediu. IARC îl plasează în categoria 3 (clasificare acțiune imposibilă în ceea ce privește cancerigenul pentru oameni).
Inhalarea fumului de iodometan poate afecta plămânii , ficatul, rinichii și sistemul nervos . Provoacă greață , amețeli, tuse și vărsături . Contactul prelungit cu pielea provoacă arsuri . Inhalarea poate provoca edem pulmonar masiv.
Toxicitatea sa derivă din acțiunea sa puternică de metilare: enzimele care conțin grupări sulfhidril -SH sunt afectate în special de efectul acestui tip de substanță și sunt inhibate. Sistemul nervos central este deosebit de afectat, unde lipsa acestor enzime provoacă daune grave.
Notă
- ^ Sigma Aldrich; rev. din 13.05.2014
- ^ KR Redeker, N.-Y. Wang, JC Low, A. McMillan, SC Tyler și RJ Cicero, Emisiile de halogenuri de metil și metan de la Rice Paddies , în Știința , vol. 290, nr. 5493, 2000, pp. 966-969, DOI : 10.1126 / science.290.5493.966 , PMID 11062125 .
- ^ (EN) Marla Cone, EPA OKs utilizează pesticide toxice pe câmpuri , în Los Angeles Times, 6 octombrie 2007. Accesat la 4 martie 2011.
- ^ A b King, CS; Hartman, WW (1943), Iodură de metil Arhivat la 5 iunie 2011 la Internet Archive . Org. Sintetizator. , Col. Vol. 2: 399
- ^ Sulikowski, Gary A.; Sulikowski, Michelle M.; Haukaas, Michael H.; Luna, Bongjin (2005). „Iodometan”. e-EROS. DOI : 10.1002 / 047084289X.ri029m.pub2
- ^ Avila-Zárraga, JG, Martinez, R., Metilarea eficientă a acizilor carboxilici cu hidroxid de potasiu / metil sulfoxid și iodometan , în Synthetic Communications, vol. 31, n. 14, ianuarie 2001, pp. 2177-2183, DOI : 10.1081 / SCC-100 104 469 .
- ^ Johnson, MK, Metabolismul iodometanului la șobolan, în Biochem. J. , voi. 98, 1966, pp. 38-43, PMID 5938661 .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere cu iodometan
Wikimedia Commons conține imagini sau alte fișiere cu iodometan
| Controlul autorității | LCCN (EN) sh2011000498 · GND (DE) 4298750-7 |
|---|