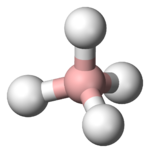
Tetrahidroborat
| Tetrahidroborat | |
|---|---|
| Numele IUPAC | |
| Tetrahidroborat (1–), boranuid | |
| Caracteristici generale | |
| Formula moleculară sau brută | BH 4 - |
| Masa moleculară ( u ) | 14,84 |
| numar CAS | Numărul CAS este nevalid |
| Informații de siguranță | |
Tetrahidroboratul este numele anionului cu formula BH 4 - . Alte denumiri pentru această specie sunt borohidrida și tetrahidroboratul , ambele fiind încă utilizate, deși considerate învechite de IUPAC. [1] BH 4 - este o specie tetraedrică, izostructurală cu speciile izoelectronice CH 4 și NH 4 + . Distanța B - H este de 126 pm . Termenii borohidrură și tetrahidroborat sunt, de asemenea, utilizați pentru a desemna anioni derivați, care au formula generală BH 4-n X n - , cum ar fi cianoborohidrida (B (CN) H 3 - ) și trietilborohidrura (B (C 2 H 5 ) 3 H - ).
Anionul BH 4 - este prezent în multe săruri ; cele mai importante sunt borohidrura de sodiu și borohidrura de litiu . Acești compuși sunt folosiți pe scară largă ca agenți reducători în sinteza organică . [2] [3]
fundal
Sarea de litiu a anionului BH 4 - a fost descrisă în 1940 de Hermann Irving Schlesinger și Herbert C. Brown . [4] Ulterior au fost sintetizate alte săruri de metale alcaline, preparate în funcție de reacție: [5]
Sinteză
In laborator, săruri conținând BH 4 - ion poate fi preparat pornind de la diboran sau trifluorura de bor . [2] De exemplu:
- 2 LiH + B 2 H 6 → 2LiBH 4
- 4LiH + BF 3 → LiBH 4 + 3 LiF
Industrial există două procese pentru sintetizarea anionului BH 4 - . În ambele cazuri sarea de sodiu este izolată: [3]
- 4 NaH + B (OCH 3 ) 3 → NaBH 4 + 3 NaOCH 3
- Na 2 B 4 O 7 • 7 SiO 2 +16 Na + 8 H 2 → 4 Naa 4 + 7 Na 2 SiO 3
Sărurile formate cu metalele alcaline sunt compuși ionici albi, cu un punct de topire ridicat, sensibili la umiditate, dar nu la oxigen . Cu metale de tranziție , lantanide și actinide , se formează compuși covalenți cu puncte de topire scăzute sau compuși lichizi, ușor volatili . Compușii formați cu metale alcalino-pământoase au caracteristici intermediare între covalent și ionic. [6] [7]
Proprietăți de coordonare
Deși , în general considerate a fi substanțial necoordinativ , BH 4 - anion are foarte bogat chimie coordonare . [8] [9] BH 4 - poate utiliza legături tri-centrale și doi electroni B - H - M pentru a se coordona cu un metal cu electropozitiv redus și poate face acest lucru folosind unul, doi sau trei atomi de hidrogen (coordonarea η 1 , η 2 sau η 3 ). Sunt, de asemenea, cunoscuți complexe care conțin anioni BH 4 - coordonați în moduri diferite (de exemplu [U (η 2 -BH 4 ) (η 3 -BH 4 ) 2 (dimetilfosfinoetan) 2 ]) și cazurile în care BH 4 - poate acționa ca ligand a face legătura între două metale. [2] [8]
Notă
Bibliografie
- ( EN ) M. Besora și A. Lledós, Moduri de coordonare și dinamica schimbului de hidruri în complexe de tetrahidroborat metalic de tranziție , în structură și legătură , vol. 130, 2008, pp. 149–202, DOI : 10.1007 / 430_2007_076 .
- ( EN ) NG Connelly, T. Damhus, RM Hartshorn și AT Hutton (eds), Nomenclatura chimiei anorganice - Recomandările IUPAC 2005 ( PDF ), Cambridge, Marea Britanie, Editura RCS, 2005, ISBN 0-85404-438-8 .
- ( EN ) NN Greenwood și A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ( DE ) AF Holleman și N. Wiberg, Lehrbuch der Anorganischen Chemie , Berlin, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1 .
- ( EN ) TJ Marks și JR Kolb, metale de tranziție covalente , complexe lantanide și actinide tetrahidroborate , în Chem. Rev. , vol. 77, nr. 2, 1977, pp. 263–293, DOI : 10.1021 / cr60306a004 .
- (RO) P. Rittmeyer și U. Wietelmann, hidruri, în Enciclopedia Ullmann de Chimie Industrială, Wiley-VCH, 2002, DOI : 10.1002 / 14356007.a13_199 .
- ( EN ) HC Schlesinger și HR Brown, Borohidride metalice. III. Borohidrură de litiu , în J. Am. Chem. Soc. , Vol. 62, nr. 12, 1940, pp. 3429-3435, DOI : 10.1021 / ja01869a039 .
- ( EN ) HC Schlesinger, HR Brown și LR Hoekstra, Reacțiile Diboranului cu hidrurile metalelor alcaline și compușii lor de adăugare. Noi sinteze de borohidride. Borohidruri de sodiu și potasiu , în J. Am. Chem. Soc. , Vol. 75, nr. 1, 1953, pp. 199-204, DOI : 10.1021 / ja01097a053 .
- ( EN ) A. Züttel, A. Borgschulte și S.-I. Orimo, Tetrahidroborați ca noi materiale de stocare a hidrogenului , în Scripta Materialia , vol. 56, nr. 10, 2007, pp. 823-828, DOI : 10.1016 / j.scriptamat.2007.01.010 .