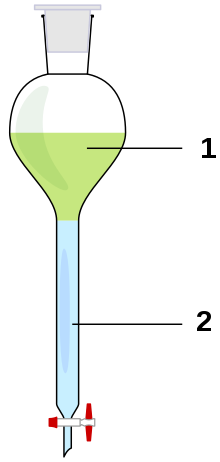
Extracție lichid-lichid
Extracția lichid-lichid (indicată prin acronimul LLE , din extracția engleză lichid-lichid ) reprezintă trecerea unui solut de la un solvent la alt solvent diferit. Este o metodă de laborator utilizată pentru obținerea compușilor puri din surse animale sau vegetale sau pur și simplu pentru purificarea substanțelor impure. Sunt utilizate două tipuri de solvenți, cu niveluri diferite de polaritate și miscibilitate reciprocă: cei care sunt mai densi și, prin urmare, mai grei decât apa, cum ar fi diclormetanul , tetraclorura de carbon și cloroformul și cei mai puțin densi și, prin urmare, mai ușori decât apa, cum ar fi eterul de petrol , etilul acetat , benzen și etil eter .
Când cele două lichide sunt introduse în pâlnia separatoare, datorită amestecării manuale, acestea sunt împărțite în două faze (una apoasă și una organică care conține substanța extrasă) și ajung la un echilibru între concentrația solutului din primul solvent și concentrația de solutul din al doilea solvent. Acest echilibru poate fi exprimat grație coeficientului de partiție K dat de raportul dintre concentrațiile (g / l) de substanță dizolvată din cei doi solvenți. În mod ideal, raportul activităților speciilor supuse examinării în cele două faze este constant și independent de cantitatea sa totală. Adică la o anumită temperatură:
K = C a / C b (la constanta T)
- C a = concentrația de echilibru a substanței în faza "a"
- C b = concentrația de echilibru a substanței în faza "b"
Cunoscută sub numele de ecuația de distribuție Nernst .
În realitate, constanta de distribuție este dată de relația dintre activitățile substanței în cele două faze dar, într-un mod similar cu echilibrele, activitățile pot fi înlocuite, în multe condiții, cu concentrații molare fără a genera erori. Această ipoteză se dovedește a fi adevărată atunci când puterea ionică (I) a celor două faze nu implică o valoare a activității unui dizolvat care este semnificativ diferită de concentrația sa. În general, valoarea numerică a lui K este aproximativ egală cu raportul solubilităților lui A în fiecare solvent.
Prin distilarea fazei care conține solutul pur de obținut, solidul va rămâne pe fund în timp ce solventul distilat poate fi reciclat.
În mod normal, în chimia organică una dintre cele două faze este apa și cealaltă este un solvent organic; cu cât este mai mare K, cu atât este mai mare precizia extracției.
Tehnicile de separare mai sensibile se bazează pe același principiu (în general) și sunt incluse în ramura chimiei cromatografice analitice.
Bibliografie
- (EN) Robert Perry , Dow.W. Green, Perry's Chemical Engineers 'Handbook , ediția a VIII-a, McGraw-Hill, 2007, ISBN 0-07-142294-3 .
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre extracția lichid-lichid
Wikimedia Commons conține imagini sau alte fișiere despre extracția lichid-lichid
linkuri externe
- ( RO ) IUPAC Gold Book, „extracție lichid-lichid” , pe goldbook.iupac.org .