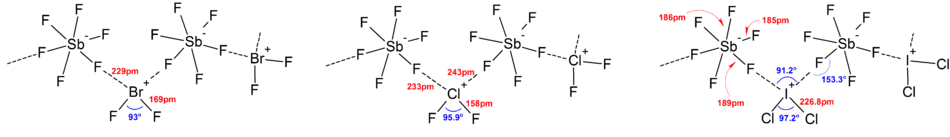Ioni polilogen
Ionii polihalogeni sunt un grup de cationi poliatomici și anioni care conțin doar elemente halogenate (grupul VIIA tabel periodic: F, Cl, Br, I, At). Acești ioni pot fi clasificați în două clase: izopolilogeni care conțin un singur tip de halogen și heteropolilogeni cu mai mult de un tip de halogen.
Introducere
Astăzi știm despre numeroși ioni polihalogeni, iar sărurile lor au fost izolate în stare solidă și studiate în structură. Tabelul de mai jos rezumă speciile găsite până acum. [1] [2] [3] [4] [5]
Cationi polialogeni
Cationi izopolilogeni Specii diatomice * [Cl 2 ] + , [Br 2 ] + , [I 2 ] + Specii triatomice [Cl 3 ] + , [Br 3 ] + , [I 3 ] + Specii tetratomice [Cl 4 ] + , [I 4 ] 2+ Specii pentatomice [Br 5 ] + , [I 5 ] + Specii heptatomice † [I 7 ] + Specii mai mult de 6 atomi [I 15 ] 3+
- * [Cl 2 ] + există doar ca [Cl 2 O 2 ] 2+ la temperaturi scăzute, se numește complex de transfer de încărcare de la O 2 la [Cl 2 ] + . [2] Cationul liber [Cl 2 ] + este detectat de spectrul său de bandă de electroni obținut într-un tub de descărcare la presiune scăzută. [3]
- † Existența [I 7 ] + este posibilă, dar rămâne incertă. [1]
Cationi heteropolilogeni Specii triatomice [ClF 2 ] + , [Cl 2 F] + , [BrF 2 ] + , [IF 2 ] + , [ICl 2 ] + , [IBrCl] + , [IBr 2 ] + , [I 2 Cl] + , [ I 2 Br] + Specii pentatomice [ClF 4 ] + , [BrF 4 ] + , IF 4 ] + , [I 3 Cl 2 ] + Specii heptatomice [ClF 6 ] + , [BrF 6 ] + , IF 6 ] +
Anioni polihalogeni
Anioni izopolilogeni Specii triatomice [Cl 3 ] - , [Br 3 ] - , [I 3 ] - Specii tetratomice [Br 4 ] 2− , [I 4 ] 2− Specii pentatomice [I 5 ] - Specii heptatomice [I 7 ] - Specii octatomice [Br 8 ] 2− , [I 8 ] 2− Specii mai mult de 8 atomi [I 9 ] - , [I 10 ] 2− , [I 10 ] 4− , [I 11 ] - , [I 12 ] 2− , [I 13 ] 3− , [I 16 ] 2− , [I 22 ] 4− , [I 26 ] 3− , [I 26 ] 4− , [I 28 ] 4− , [I 29 ] 3−
Anioni heteropolilogeni Specii triatomice [ClF 2 ] - , [BrF 2 ] - , [BrCl 2 ] - , [IF 2 ] - , [ICl 2 ] - , [IBrF] - , [IBrCl] - , [IBr 2 ] - , [I 2 Cl ] - , [I 2 Br] - , [AtBrCl] - , [AtBr 2 ] - , [AtICl] - , [AtIBr] - , [AtI 2 ] - Specii pentatomice [ClF 4 ] - , [BrF 4 ] - , [IF 4 ] - , [ICl 3 F] - , [ICl 4 ] - , [IBrCl 3 ] - , [I 2 Cl 3 ] - , [I 2 BrCl 2 ] - , [I 2 Br 2 Cl] - , [I 2 Br 3 ] - , [I 4 Cl] - , [I 4 Br] - Hexatomic specific [IF 5 ] 2− Specii heptatomice [ClF 6 ] - , [BrF 6 ] - , [IF 6 ] - , [I 3 Br 4 ] - Specii nonatomice [IF 8 ] -
Structura
Majoritatea structurilor au fost determinate prin spectroscopie IR , spectroscopie Raman și cristalografie cu raze X. Ionii polihalogenici au întotdeauna halogenul mai greu și mai puțin electronegativ prezent în ion ca atom central, făcând ionul asimetric în unele cazuri. De exemplu, [Cl 2 F] + are structura [Cl - Cl - F] - dar nu [Cl - F - Cl] - .
Ioni izopolilogeni
Ioni heteropolilogeni
În general, structurile majorității ionilor heteropolilogeni și ai ionilor izopolilogeni reduși sunt în acord cu modelul VSEPR . Cu toate acestea, au existat cazuri excepționale. De exemplu, atunci când atomul central este greu și are șapte perechi solitare , cum ar fi [BrF 6 ] - și [IF 6 ] - , acestea au un aranjament octaedric regulat de liganzi de fluor în loc de unul distorsionat datorită prezenței efectului de cuplu inert . Alte abateri de la modelul ideal VSEPR au fost găsite în structurile în stare solidă datorită interacțiunii puternice anion-cation, ceea ce complică interpretarea datelor spectroscopiei vibraționale . În toate structurile cunoscute ale sărurilor anionice polialogene, anionii intră în contact foarte strâns, prin punți cu halogen, cu contracationii. [4]
De exemplu, în stare solidă, [IF 6 ] - nu este un octaedru regulat, de fapt structura solidă a compușilor [Me 4 N] + [IF 6 ] - dezvăluie dimeri [I 2 F 11 ] 2− legați slab . Interacțiuni cation-anion semnificative au fost, de asemenea, găsite în următorii compuși:
- [BrF 2 ] + [SbF 6 ] - ,
- [ClF 2 ] + [SbF 6 ] - ,
- [BrF 4 ] + [Sb 6 F 11 ] - . [2]
Structura generală a ionilor heteropolilogeni comuni Liniar (sau aproape liniar) [ClF 2 ] - , [BrF 2 ] - , [BrCl 2 ] - , [IF 2 ] - , [ICl 2 ] - , [IBr 2 ] - , [I 2 Cl] - , [I 2 Br] - Ghidon [ClF 2 ] + , [Cl 2 F] + , [BrF 2 ] + , [IF 2 ] + , [ICl 2 ] + , [I 2 Cl] + , [IBr 2 ] + , [I 2 Br] + , [IBrCl] + Pătrat plan [ClF 4 ] - , [BrF 4 ] - , [IF 4 ] - , [ICl 4 ] - Disfenoid (sau balansoar) [ClF 4 ] + , [BrF 4 ] + , [IF 4 ] + Pentagonal planar ‡ [IF 5 ] 2− Octahedral [ClF 6 ] + , [BrF 6 ] + , [IF 6 ] + , § [ClF 6 ] - , [BrF 6 ] - , [IF 6 ] - Antiprismatic pătrat [IF 8 ] -
- ‡ [IF 5 ] 2− este una dintre cele două specii de tipuri XY n cunoscute ca având geometria plană pentagonală rară, cealaltă fiind anionul pentafluoroxeniu [XeF 5 ] - .
- § [ClF 6 ] - este distorsionat octaedric, deoarece efectul pereche inert stereochimic nu este semnificativ în atomul de clor.
Ionii [I 3 Cl 2 ] + și [I 3 Br 2 ] + au o structură de tip trans - Z , ca cea a cationului [I 5 ] + .
Poliioduri
Ionii polididici au o structură mult mai complicată. Cele discrete au de obicei o secvență liniară de atomi și ioni și sunt descrise în termeni de asociere între unitățile I 2 , I - și I - 3 , care reflectă originea poliiodurii. În stare solidă, acești ioni interacționează între ei formând lanțuri, inele sau chiar rețele bidimensionale și tridimensionale complicate.
Legături
În legătura ionilor de polihalogen, se remarcă în principal utilizarea predominantă a orbitalilor p. Participarea semnificativă a orbitalilor d la legare este puțin probabilă, deoarece ar fi necesară multă energie promoțională, în timp ce participarea scăzută a orbitalilor s la speciile care conțin iod este de așteptat datorită efectului de pereche inertă , după cum reiese din datele spectroscopiei Mössbauer . Cu toate acestea, niciun model de legătură nu a reușit să reproducă o gamă atât de largă de lungimi și unghiuri de legătură observate până acum. [3]
Cum era de așteptat din faptul că un electron este scos din orbital antibonding așa X2 este ionizat la [X 2] +, ordinea de obligațiuni și obligațiuni puterea în [X 2] + devin mai mari, ca urmare distantele interatomice in molecular ion sunt mai mici decât cele din X 2 .
Polialogenii triatomici liniari sau aproape lineari au legături mai slabe și mai lungi decât cele ale interhalogenilor diatomici sau halogeni corespunzători, în concordanță cu repulsia suplimentară între atomi atunci când ionul halogen este adăugat la molecula neutră. Un alt model implică existența teoriei rezonanței , de exemplu, [ICl 2 ] - poate fi văzut ca un hibrid de rezonanță al următoarelor forme canonice :
Dovezi care susțin acest model provin din lungimea legăturii (255 pm în [ICl 2 ] - și 232 pm în ICl (g)) și din alungirea legăturii simetrice și antisimetrice în numărul de undă (267 și 222 cm -1 în [ICl 2 ] - comparativ cu 384 cm -1 în ICl), ceea ce indică o ordine de legătură de aproximativ 1/2 pentru fiecare legătură I - Cl în [ICl 2 ] - , în concordanță cu interpretarea utilizării teoriei rezonanței. Alte specii triatomice [XY 2 ] - au același comportament. [2]
Sinteză
Formarea ionilor de polihalogen are loc prin auto-disocierea rudelor lor interhalogen sau halogen :
- 2 XY n [XY n −1 ] + + [XY n +1 ] -
- 3 X 2 [X 3 ] + + [X 3 ] -
- 4 X 2 [X 5 ] + + [X 3 ] -
- 5 X 2 2 [X 2 ] + + 2 [X 3 ] -
Cationi polialogeni
Există două metode pentru prepararea cationilor polialogeni:
- Reacția interhalogenului adecvat cu un acid Lewis (cum ar fi halogenurile B , Al , P , As , Sb ) atât într-un solvent inert sau oxidant (cum ar fi HF anhidru), fie fără, pentru a da un cation heteropolilogen.
- XY n + MY m → [XY n −1 ] + + [MY m +1 ] -
- Printr-un proces oxidativ, în care halogenul sau interhalogenul reacționează cu un oxidant și un acid Lewis pentru a da cationul:
De obicei, prima metodă este utilizată în sinteza cationilor heteropolilogeni, iar a doua se aplică ambelor. Procesul oxidativ este indispensabil în sinteza cationilor [IBr 2 ] + , [ClF 6 ] + , [BrF 6 ] + și, la fel ca părinții lor interhalogeni, IBr 3 , ClF 7 , BrF 7 , nu au fost niciodată izolați:
- Br 2 + IOSO 2 F → [IBr 2 ] + [SO 3 F] -
- 2 CLF 5 + 2 6 → PTF [CLF 6] + [6 PTF] - + [CLF 4] + [6 PTF] -
- BrF 5 + [KrF] + [AsF 6 ] - → [BrF 6 ] + [AsF 6 ] - + Kr
Sinteza unor specii este descrisă în tabelul următor cu ecuațiile respective: [1] [2] [3] [4]
Sinteza cationilor polialogeni Specii Ecuația chimică Condiții necesare [Cl 2 ] + (ca [Cl 2 O 2 ] + ) Cl 2 + [O 2 ] + [SbF 6 ] - → [Cl 2 O 2 ] + [SbF 6 ] - în HF anhidru la temperatură scăzută [Br 2 ] + Br 2 (în BrSO 3 F) + 3 SbF 5 → [Br 2 ] + [Sb 3 F 16 ] - (neechilibrat) la T = 300 K [I 2 ] + 2 I 2 + S 2 O 6 F 2 → 2 [I 2 ] + [SO 3 F] - în HSO 3 F
[Cl 3 ] + Cl 2 + ClF + AsF 5 → [Cl 3 ] + [AsF 6 ] - la T = 195 K [Br 3 ] + 3 Br 2 + 2 [O 2 ] + [AsF 6 ] - → 2 [Br 3 ] + [AsF 6 ] - + 2 O 2 [I 3 ] + 3 I 2 + S 2 O 6 F 2 → 2 [I 3 ] + [SO 3 F] - [Cl 4 ] + 2 Cl 2 + IrF 6 → [Cl 4 ] + [IrF 6 ] - în HF anhidru, la T <193 K [I 4 ] 2+ 2 I 2 + 3 AsF 5 → [I 4 ] 2+ [AsF 6 - ] 2 + AsF 3 în SO 2 lichid [Br 5 ] + 8 Br 2 + 3 [XeF] + [AsF 6 ] - → 3 [Br 5 ] + [AsF 6 ] - + 3 Xe + BrF 3 [I 5 ] + 2 I 2 + ICl + AlCl 3 → [I 5 ] + [AlCl 4 ] - [I 7 ] + 7 I 2 + S 2 O 6 F 2 → 2 I 7 SO 3 F [ClF 2 ] + ClF 3 + AsF 5 → [ClF 2 ] + [AsF 6 ] - [Cl2 F] + 2 ClF + AsF 5 → [Cl 2 F] + [AsF 6 ] - la T <197 K [BrF 2 ] + 5 BrF 3 + 2 Au → 3 BrF + 2 [BrF 2 ] + [AuF 4 ] - este necesar mai mult reactiv BrF 3 [IF 2 ] + IF 3 + AsF 5 → [IF 2 ] + [AsF 6 ] - [ICl 2 ] + ICl 3 + SbCl 5 → [ICl 2 ] + [SbCl 6 ] - [IBr 2 ] + Br 2 + IOSO 2 F → [IBr 2 ] + [SO 3 F] - [ClF 4 ] + ClF 5 + SbF 5 → [ClF 4 ] + [SbF 6 ] - [BrF 4 ] + BrF 5 + AsF 5 → [BrF 4 ] + [AsF 6 ] - [IF 4 ] + IF 5 + 2 SbF 5 → [IF 4 ] + [Sb 2 F 11 ] - [ClF 6 ] + ‡ Cs 2 nDacã 6 + 5 Asf 5 + CLF 5 → [CLF 6] + [asf 6] - + Ni [Asf 6] 2 + 2 CsAsF 6 [BrF 6 ] + [KrF] + [AsF 6 ] - + BrF 5 → [BrF 6 ] + [AsF 6 ] - + Kr [IF 6 ] + IF 7 + BrF 3 → [IF 6 ] + [BrF 4 ] -
Anioni polihalogeni
Pentru anioni polialogeni, există, de asemenea, două metode generale de sinteză:
- Reacția unui interhalogen sau halogen cu o bază Lewis , cel mai probabil o fluorură:
- [Et 4 N] + Y - + XY n → [Et 4 N] + [XY n +1 ] -
- X 2 + X - → X - 3
- Prin oxidarea unui halogen simplu:
- KI + Cl 2 → K + [ICl 2 ] -
Pregătirea unor specii este rezumată pe scurt în tabelul următor cu ecuațiile respective: [1] [2] [3] [4]
Sinteza anionilor polialogenici Specii Ecuația chimică Condiții necesare [Cl 3 ] - , [Br 3 ] - , [I 3 ] - X 2 + X - → [X 3 ] - (X = Cl, Br, I) [Br 3 ] - Br 2 + [ n Bu 4 N] + Br - → [ n Bu 4 N] + [Br 3 ] - în 1,2-dicloroetan sau dioxid de sulf lichid. [Br 3 ] - nu există în soluție și se formează numai atunci când sarea cristalizează. [Br 5 ] - 2 Br 2 + [ n Bu 4 N] + Br - → [ n Bu 4 N] + [Br 5 ] - în 1,2-dicloretan sau dioxid de sulf lichid, cu exces de reactiv Br 2 [ClF 2 ] - ClF + CsF → Cs + [ClF 2 ] - [BrCl 2 ] - [6] Br 2 + Cl 2 + 2 CsCl → 2 Cs + [BrCl 2 ] - [ICl 2 ] - [6] KI + Cl 2 → K + [ICl 2 ] - [IBr 2 ] - [6] CsI + Br 2 → Cs + [IBr 2 ] - [AtBr 2 ] - , [AtICl] - , [AtIBr] - , [AtI 2 ] - La Y + X - → [AtXY] - (X = I, Br, Cl; Y = I, Br) [ClF 4 ] - NOF + ClF 3 → [NO] + [ClF 4 ] - [BrF 4 ] - 6 KCl + 8 BrF 3 → 6 K + [BrF 4 ] - + 3 Cl 2 + Br 2 cu exces de reactiv BrF 5 [IF 4 ] - 2 XeF 2 + [Me 4 N] + I - → [Me 4 N] + [IF 4 ] - + 2 Xe reactanții sunt amestecați la 242 K, apoi încălziți la 298 K pentru ca reacția să continue [ICl 4 ] - [6] KI + ICl 3 → K + [ICl 4 ] - [IF 5 ] 2− IF 3 + 2 [Me 4 N] + F - → [Me 4 N + ] 2 [IF 5 ] 2− [IF 6 ] - IF 5 + CsF → Cs + [IF 6 ] - [I 3 Br 4 ] - [PPh 4 ] + Br - + 3 IBr → [PPh 4 ] + [I 3 Br 4 ] - [IF 8 ] - IF 7 + [Me 4 N] + F - → [Me 4 N] + [IF 8 ] - în acetonitril
Cele mai mari polioduri se formează la cristalizarea soluțiilor care conțin diverse concentrații de I - și I 2 . De exemplu, KI 3 monohidrat cristalizează atunci când o soluție saturată conținând cantități adecvate de I 2 și KI este răcită. [6]
Proprietate
Stabilitate
În general, o cantitate mare de cationi sau anioni (cum ar fi Cs + , [SbF 6 ] - ) pot ajuta la stabilizarea ionilor de polihalogen formați în stare solidă din considerente de energie de rețea , crescând eficiența ambalării.
Cationii polihalogeni sunt agenți oxidanți puternici, după cum se indică prin faptul că pot fi preparați numai în lichide oxidante, cum ar fi solvenți, de exemplu oleum . Cele mai oxidante și, prin urmare, cele mai instabile specii sunt [X 2 ] + și [XF 6 ] + (X = Cl, Br), apoi urmează [X 3 ] + și [IF 6 ] + .
Stabilitatea sărurilor [X 2 ] + (X = Br, I) indică faptul că acestea sunt termodinamice. Pe de altă parte, stabilitatea lor în soluție depinde de solventul superacid . De exemplu, [I 2 ] + este stabil în HF de aciditate maximă (HF cu 0,2 N SbF 5 , H 0 = -20,65), dar disproporționat față de [I 3 ] + , [I 5 ] + și I 2 pe măsură ce scade aciditate prin adăugarea de cantități diferite de NbF 5 , TaF 5 sau NaF . [4]
- 14 [I 2 ] + + 5 F - → 9 [I 3 ] + + IF 5
Pentru anioni polihalogeni cu același cation, cei mai stabili sunt cei cu un halogen mai greu în centru, ionii simetrici sunt, de asemenea, mai stabili decât cei asimetrici, deci stabilitatea scade în următoarea ordine:
- [I 3 ] - > [IBr 2 ] - > [ICl 2 ] - > [I 2 Br] - > [Br 3 ] - > [BrCl 2 ] - > [Br 2 Cl] -
Ionii heteropolilogeni cu un număr de coordonare mai mare sau egal cu patru pot exista doar cu liganzi fluoruri.
Culoare
Majoritatea ionilor de polihalogen sunt intens colorate, cu o culoare mai profundă pe măsură ce crește greutatea atomică a elementului constitutiv. Cunoscutul complex amidon- iod are o culoare albastru intens datorită prezenței ionilor liniari [I 5 ] - în helixul amiloză . [4] Mai jos este o listă a speciilor comune și a culorilor asociate compușilor lor: [3]
- fluorocări incolore sau galben pal, altele sunt portocalii, roșii sau violet intens [4]
- [ICl 2 ] + vin roșu până la portocaliu strălucitor;
- [I 2 Cl] + maro închis până la negru violet
- [Cl 3 ] + galben
- [Cl 4 ] + albastru [2]
- [Br 2 ] + roșu vișiniu
- [Br 3 ] + maro
- [Br 5 ] + maro închis
- [I 2 ] + albastru strălucitor
- [I 3 ] + maro închis sau negru
- [I 4 ] 2+ roșu sau maro
- [I 5 ] + verde sau negru, sarea [I 5 ] + [AlCl 4 ] - există ca ace negru-verzui, dar apare maro-roșu în secțiuni subțiri
- [I 7 ] + negru, existența sa în compusul I 7 SO 3 F a fost confirmată
- [I 15 ] 3+ negru [5]
- [ICl 4 ] - galben auriu
- poliiodurile au culori foarte închise, fie maro închis, fie albastru închis
Proprietăți chimice
Cationii heteropolilogeni sunt oxidanți reactivi explozivi și au adesea o reactivitate mai mare decât părinții lor interhalogeni prin descompunerea prin căi reductive. După cum se prezice prin starea maximă de oxidare +7 în [ClF 6 ] + , [BrF 6 ] + și [IF 6 ] + , aceștia sunt agenți de oxidare puternici, conform următoarelor reacții:
- 2 O 2 + 2 [BrF 6 ] + [AsF 6 ] - → 2 [O 2 ] + [AsF 6 ] - + 2 BrF 5 + F 2
- Rn + [IF 6 ] + [SbF 6 ] - → [RnF] + [SbF 6 ] - + IF 5
Cationii polialogen cu stări de oxidare mai mici tind să fie disproporționate . De exemplu, [Cl 2 F] + este instabil în soluție și complet disproporționat în HF / SbF 5 chiar la 197 K:
- 2 [Cl 2 F] + → [ClF 2 ] + + [Cl 3 ] +
[I 2] + reversibil DIMS la 193 K și sa observat că culoarea albastră a paramagnetic cation [l2] + modificări la roșu-brun al diamagnetic cation [I 2] +, împreună cu o scădere a paramagnetic susceptibilitatea și conductivitatea electrică atunci când soluția este răcită sub 193 K: [2]
- 2 [I 2 ] + [I 4 ] 2+
Dimerizarea poate fi atribuită suprapunerii orbitelor π * pe jumătate umplute în cele două [I 2 ] + .
[Cl 4 ] + în [Cl 4 ] + [IrF 6 ] - are aceeași structură ca [I 4 ] 2+ , dar se descompune la 195 K dând săruri de [Cl 3 ] + în loc de [Cl 2 ] + și Cl 2 . [2]
Încercările de a prepara ClF 7 și BrF 7 prin fluorurarea [ClF 6 ] + și [BrF 6 ] + cu NOF au eșuat, cu toate acestea au avut loc următoarele reacții: [3]
- [ClF 6 ] + [PtF 6 ] - + NOF → [NO] + [PtF 6 ] - + ClF 5 + F 2
- [BrF 6 ] + [AsF 6 ] - + 2 NOF → [NO] + [AsF 6 ] - + [NO] + [BrF 6 ] - + F 2
Anionii sunt mai puțin reactivi decât cationii și sunt în general oxidanți mai slabi decât părinții lor interhalogeni. Sunt mai puțin reactivi în compușii organici și unele săruri au o stabilitate termică destul de ridicată. Sărurile cu anioni polihalogeni de tip M + [X m Y n Z p ] - (unde 1 = m + n + p = 3, 5, 7, 9 ...) au tendința de a se disocia în săruri monohalidice simple între M + și halogenul mai electronegativ , astfel încât monohalura are cea mai mare energie de rețea. Celălalt produs este de obicei un interhalogen. Sarea [Me 4 N] + [ClF 4 ] - se descompune la aproximativ 100 ° C, iar sărurile [ClF 6 ] - sunt instabile termic și pot exploda chiar la -31 ° C. [4]
Notă
- ^ a b c d R. Bruce King, Clor, brom, iod și astat: chimie anorganică , în Enciclopedia chimiei anorganice , 2, Wiley, 2005, p. 747, ISBN 9780470862100 .
- ^ a b c d e f g h i Catherine E. Housecroft și Alan G. Sharpe, Capitolul 17: Grupul 17 elemente , în Chimie anorganică , 3rd, Pearson, 2008, p. 547, ISBN 978-0-13-175553-6 .
- ^ a b c d e f g Greenwood, Norman N .; Earnshaw, Alan (1997). Chimia elementelor (ed. A II-a). Butterworth-Heinemann . p. 835.ISBN 0-08-037941-9 .
- ^ a b c d e f g h F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo și Manfred Bochmann,Advanced Inorganic Chemistry , 6th, Wiley, 1999, ISBN 978-0471199571 .
- ^ a b Egon Wiberg, Nils Wiberg și Arnold Frederick Holleman, Chimie anorganică , Academic Press, 2001, pp. 419-420, ISBN 0-12-352651-5 .
- ^ a b c d e G. Brauer, Handbook of Preparative Inorganic Chemistry , 2nd, New York, Academic Press, 1963.