Cromatina
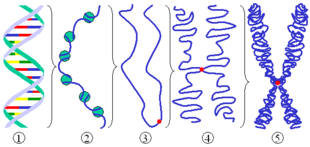
(1) ADN bicatenar
(2) Cromatină: catenă ADN cu histone
(3) Cromatina nu se condensează în timpul interfazei
(4) Cromatina condensată în timpul profazei (sunt prezente două copii ale moleculelor de ADN)
(5) Cromozom în timpul metafazei .
Cromatina este substanța care formează nucleul celular al organismelor eucariote în timpul fazei funcționale a celulei ( interfază ). Este alcătuit din ADN asociat cu proteine bazice numite histone , proteine acide și ARN . [1]
În interfază cromatina apare ca un fir de „colier de perle” în care ADN-ul este pliat pe grupuri de histone formând structuri numite nucleozomi , care permit accesul la enzima ARN polimerază pentru transcrierea acesteia și ulterior la ADN polimeraza pentru duplicare. Mai mult, pe baza tipurilor de gene transcrise, cromatina este mai puțin condensată atunci când este asociată cu gene active transcripțional ( euchromatin ) decât cu gene inactive (heterocormatin). Modificările epigenetice ale histonelor duc la modificarea structurii cromatinei. Pe măsură ce ciclul celular progresează, există o creștere treptată a compactării cromatinei până la apariția mitozei și apariția cromozomilor .
Numele de cromatină, dat de Walther Flemming în 1879, derivă istoric din colorarea intensă asumată de miez pentru coloranții de bază .
Mod de ambalare a cromatinei
Există diferite niveluri de organizare a cromatinei:
- Fibra cu diametrul de 11 nm este primul nivel, este o etapă numită „sârmă colier de perle” datorită aspectului său. În această etapă, ADN-ul este înfășurat în jurul histonelor , fără a se plia în continuare.
- Fibra cu diametrul de 30nm este al doilea nivel. În ea, cromatina capătă un aspect solenoidal grație interacțiunilor dintre cozile histonelor unui nucleozom, cu cele ale nucleozomilor adiacenți, precum și datorită histonelor H1. Aceste histone sunt mai mari decât cele care formează octamerul corpului nucleozomului și se găsesc într-un raport 1: 1 cu acesta. Fiecare histonă H1 are un corp central și două cozi care aderă atât la octamer cât și la firele de ADN de intrare și de ieșire. Interacțiunea sa cu linkerul ADN, adică firul de ADN care leagă nucleozomii singulari cu lungime variabilă (de la 38 la 53 pb la om), îi permite să-l direcționeze în așa fel încât să contribuie la plierea solenoidală. Cu toate acestea, funcțiile sale în legătură cu supraîncărcarea cromatinei nu sunt pe deplin cunoscute. Fibra de 30 nm este etapa în care se găsește cromatina activă interfazică (perioada dintre două diviziuni celulare ), adică cromatina care este transcrisă.
- Fibra sau fibra buclă cu diametrul de 300 nm: cromatina se pliază mai mult pe ea însăși datorită altor proteine, numite proteine "schele", care servesc drept bază pentru structurarea buclelor, care constituie astfel domenii Topologice închise, adică independente unul de celălalt în termeni de superînfășurare .
- Fibra cu diametrul de 700 nm: cromatina se învelește singură, este diametrul cromatidelor individuale.
- Fibra cu diametrul de 1400 nm este nivelul maxim de condensare, cel al cromozomilor metafazici.
Funcțiile cromatinei
- Ambalarea ADN-ului
- întărește ADN-ul pentru a permite mitoza
- preveni deteriorarea ADN-ului
- verificați replicarea ADN și expresia genei
Tipuri de cromatină
Folosind un microscop electronic , fibrele cromatinei se disting prin condensarea lor în timpul diviziunii celulare . În timpul interfazei, cromatina este mai extinsă: această configurație este necesară pentru ca informațiile genetice să fie exprimate.
Există două tipuri de cromatină:
- eucromatină : mai puțin condensată și corespunde zonelor în care există o activitate transcripțională intensă pentru sinteza proteinelor (adică copierea moleculelor de ADN în moleculele ARN mesager, ARNm);
- Heterocromatina este componenta cea mai condensată, constituie aproximativ 10% din genom și nu pare să prezinte activitate de transcripție. Se disting două tipuri de heterocromatină: heterocromatina constitutivă, care rămâne așa pe tot parcursul dezvoltării, și este prezentă în poziții identice atât pe cromozomii omologi ai unei perechi, cât și heterocromatina facultativă, care variază în stare (relaxată și exprimată / condensată și inactivă) în funcție de diferite tipuri de celule (de exemplu: inactivarea cromozomului X pentru formarea corpului Barr) și diferitele etape de dezvoltare.
Reglarea heterocromatinei
Heterocromatina, o parte componentă a cromozomilor (în special formează centromerul și telomerii ) este alcătuită în mare parte din căi genomice necodificate. Gradul său ridicat de condensare împiedică transcrierea oricărei gene euchromatice prezente în ea, deci poate fi considerată „oprită” sau „redusă la tăcere”. Orice genă care este extrasă din eucromatină și condensată în heterocromatină este redusă la tăcere. Consecința deplasării unei gene determină, prin urmare, expresia acesteia și se numește efect de poziție. Zonele de euchromatină situate în apropierea heterocromatinei tind să aibă gene reduse la tăcere care pot fi moștenite la descendenți. Efectele de poziție sunt responsabile, printre altele, de reducerea la tăcere a unuia dintre cei doi cromozomi X la femela de mamifer. Există câteva zeci de gene care codifică proteinele aparținând grupului de proteine cromozomiale non-histonice care se leagă de secvențe histonice specifice ale octamerului nucleozomului, influențând expresia genetică a genelor prezente acolo. Conservarea proteinelor histonice în timp este parțial justificată de mecanismele de control genetic ale epigenomului .
Reglarea histonelor
Histonele, spre deosebire de ceea ce se credea anterior, sunt proteine supuse unei varietăți remarcabile de modificări covalente reversibile. Majoritatea acestor modificări apar pe coada N-terminală a octamerului, dar uneori pot apărea și pe corpul nucleozomului, în special pe lanțurile laterale de aminoacizi ale unei histone. Acetilarea lizinei sau argininei , care tinde să slăbească structura cromatinei, deoarece îndepărtează sarcina pozitivă a acestui aminoacid (în consecință, ADN-ul încărcat negativ va adera mai puțin strâns la histone) are loc prin histona acetil-transferază (HAT, histonacetil transferază) , deacetilarea lor prin deacetilază (HDAC), (mono) metilarea , dimetilarea sau trimetilarea lor printr-o serie de trei histone metil-transferaze, care corespund cu alte trei demetilaze. O lizină sau o arginină nu pot fi simultan acetilate sau metilate.
Alte posibile modificări sunt fosforilarea și ubiquitinarea serinei . Modificarea unei histone, de exemplu o metilare, poate fi reprodusă pe mai mulți nucleozomi, parcurgând distanțe mari de-a lungul cromatinei unui cromozom. Acest lucru se datorează faptului că aceleași enzime care acționează ca "scriitori" ai histonei și care, prin urmare, modifică histona, pot funcționa împreună cu proteinele "cititor" specifice care recunosc modificarea făcută doar de scriitor și acționează ca o "punte" pentru modificări ulterioare. de același tip în nucleozomii adiacenți. Procesele de „scriere” și „citire” consumă ATP. Pentru a preveni ca unul sau mai multe procese de citire-scriere să continue fără reglare de-a lungul diferitelor nucleozomi și, prin urmare, să activeze sau să reducă silențierea genelor fără discriminare, există secvențe de barieră care blochează acești complecși.
Lipsa unei secvențe de barieră poate, după cum este ușor de înțeles, să aibă efecte semnificative asupra unui organism. Aceste secvențe conțin situri de legare pentru acetilază și deacetilază, astfel încât aminoacizii săi sunt intens acetilați, împiedicând complexul cititor-scriitor să le metileze, condensându-le în heterocromatină. Histonele puternic metilate, pe de altă parte, atrag proteine de remodelare a cromatinei, precum și complexul cititor-scriitor, cu funcția de condensare (cu consum de ATP) a nucleozomilor metilați în heterocromatină.
Modificarea unei histone variază în funcție de timpii ciclului celular, iar recrutarea lor depinde de proteinele reglatoare ale genelor. Modificările, deși promovate de aceste proteine, nu sunt legate direct de ele și persistă chiar și după dispariția lor, rezultând moștenirea epigenetică. La rândul lor, aceste modificări atrag proteine de reglare specifice care au afinitate pentru un domeniu de cromatină modificat corespunzător pentru acel tip de proteină și nu pentru altele.
Este posibil să se regleze histonele dintr-un nucleozom înlocuind o parte sau o parte a octamerului cu histone alternative. Aceste histone se găsesc în cantități mult mai mici decât cele din cele patru principale care formează octamerul. Există pentru fiecare histonă, cu excepția H4. Exemple sunt H3.3, care promovează transcrierea ADN-ului înfășurat în jurul nucleozomului care îl conține, CENP-A care îndeplinește funcții la nivel de centromer și colaborează la formarea kinetocorului, H2AX, care participă la repararea ADN, H2AZ, cu un rol important în segregarea cromozomială, macroH2A, cu rol de represiune transcripțională (opusă lui H3.3) și de inactivare a unuia dintre cei doi cromozomi X la femeie. Spre deosebire de histonele octamer care sunt sintetizate în mod specific în faza S a ciclului celular, imediat după duplicarea ADN, aceste variante de histone sunt sintetizate în timpul interfazei.
Notă
Elemente conexe
Alte proiecte
-
 Wikționarul conține dicționarul lema « cromatină »
Wikționarul conține dicționarul lema « cromatină » -
 Wikimedia Commons conține imagini sau alte fișiere pe cromatină
Wikimedia Commons conține imagini sau alte fișiere pe cromatină
linkuri externe
- Cromatina , pe Treccani.it - Enciclopedii online , Institutul Enciclopediei Italiene .
- ( EN ) Chromatin , pe Encyclopedia Britannica , Encyclopædia Britannica, Inc.
- Cromatina , în Treccani.it - Enciclopedii on-line , Institutul Enciclopediei Italiene.
| Controlul autorității | Tesauro BNCF 32180 · LCCN (EN) sh85025333 · GND (DE) 4010152-6 · BNF (FR) cb12251716c (data) · NDL (EN, JA) 00.567.038 |
|---|

