Membrana celulara
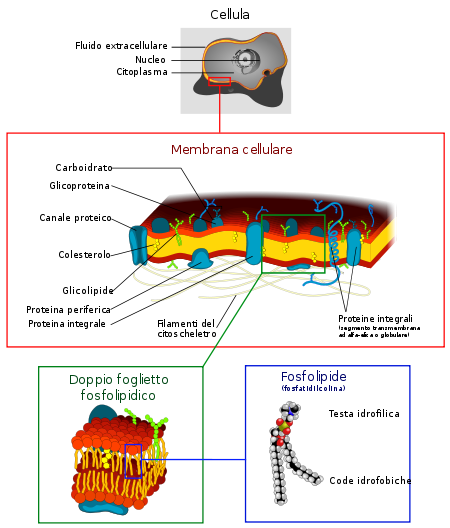
Membrana celulară , numită și membrană plasmatică , plasmalemă sau citomembrana , este un strat subțire, cu o grosime de 5-10 nm (50-100 Å) [1] , care delimitează celula în toate organismele vii, o separă de mediu extern, reglementează schimbul de elemente și substanțe chimice . În celulele eucariote , delimitează și organele din interiorul celulei.
Observațiile TEM au arătat că toate celulele sunt delimitate de o membrană.
Formată în principal de lipide , în mare parte fosfolipide , mai este numită „strat strat fosfolipidic” sau „strat strat fosfolipidic” conform sensului englezesc deoarece sunt dispuse într-un strat dublu de lipide cu capete hidrofile îndreptate spre mediul extern și către citoplasmă. În consecință, cozile hidrofobe sunt în contact unul cu celălalt „în interiorul” stratului bistrat. Acest aranjament minimizează suprafața cozilor hidrofobe în contact cu apa.
În componenta lipidică, cu funcții fiziologice importante, sunt plasate proteinele și un procent mic de carbohidrați , sub formă de glicoproteine și glicolipide , precum și molecule de colesterol care o stabilizează. Această conformație explică principalele funcții ale membranelor, în special transportul substanțelor din exteriorul celulei către interior și invers.
Există o uniformitate substanțială a structurii între plasmalemă și celelalte membrane care delimitează diferitele compartimente celulare sau organite.
La organismele eucariote animale membrana celulară este stratul cel mai exterior, în timp ce la celulele eucariote vegetale există un perete celular ; în unele procariote membrana celulară este acoperită cu un strat protector numit peretele bacterian .
Descriere
Compoziția și asimetria membranei celulare
O cantitate mare de lipide (în special fosfolipide ) se găsesc în membrana celulară.
Lipidele sunt cele mai reprezentate molecule din membrana plasmatică; lipidele de membrană din diferite celule, sau chiar în diferite organite ale aceleiași celule, pot diferi în unele caracteristici:
- lungimea cozilor hidrofobe și gradul lor de nesaturare
- structura capului polar
- prezența sterolilor
Aceste diferențe sunt legate de prezența lanțurilor laterale hidrofobe specifice care le compun.
Pe lângă componenta lipidică, există numeroase proteine (într-un raport de 1:50 la lipide; pentru fiecare proteină există aproximativ 50 de molecule lipidice), având funcții fiziologice importante. Proteinele de membrană sunt distribuite asimetric pe cele două straturi. Există proteine intrinseci care au domenii transmembranare foarte hidrofobe și proteine extrinseci care interacționează cu suprafața polară a stratului fosfolipidic și cu porțiunile de membrană suplimentare ale proteinelor intrinseci.
Există, de asemenea, un procent mic de carbohidrați (= glucide), sub formă de glicoproteine și glicolipide, și de molecule de colesterol care stabilizează membrana.
Glucidele constituie site-uri de recunoaștere care pot fi legate de proteinele care formează glicoproteine sau de lipidele care formează glicolipide.
Compoziția celor două straturi, externă și internă, a membranei celulare prezintă diferențe considerabile, nu numai în componenta proteică, ci și în componenta lipidică în sine, astfel încât membrana plasmatică se caracterizează printr-o asimetrie marcată, care reflectă diferitele funcțiile celor două monostraturi. Această asimetrie are funcții importante și este controlată fin de celulă.
Model mozaic fluid
Conform „ modelului mozaicului fluid ”, propus în 1972 de SJSinger și GLNicholson, bistratul lipidic al membranei plasmatice se află în stare lichid-cristalină și sunt imersate în el numeroase proteine care, datorită fluidității componentei lipidice, prezintă un grad considerabil de mobilitate; sunt responsabili pentru îndeplinirea majorității funcțiilor membranei. Stratul stratificat lipidic nu are un caracter omogen, dar microdomeniile lipidice mai puțin fluide sunt prezente în interiorul mozaicului fluid ( plute lipidice Simon și Ikonen, 1997 ), formate în principal din sfingolipide și colesterol în stare lichidă, care ar funcționa atât ca plute de transport ale componentelor membranei și de pe platforme pentru geneza semnalelor intracelulare, pentru care proteinele specifice sunt concentrate în ele.
În prezent, se disting două tipuri de plute lipidice: plute caveole și plute „neinvaginate”. Primele apar morfologic ca gropițe (caveole) ale suprafeței celulare și sunt caracterizate biochimic prin prezența caveolinei proteine structurale (caveolinea), esențială pentru constituirea lor. Plutele „neinvaginate” sunt platforme morfologic indistincte de porțiunea rămasă a membranei celulare; în condiții bazale, acestea au dimensiuni foarte mici, dar sunt capabile să convergă pentru a forma platforme mai mari în urma stimulării, de exemplu ca o consecință a legării receptorilor conținuți în plute cu semnalele extracelulare corespunzătoare.
Conceptul inițial al modelului de mozaic fluid, care a implicat o distribuție aleatorie a proteinelor cu o libertate largă de mișcare și rotație laterală, trebuie, prin urmare, revizuit în favoarea unui model de membrană în care domeniile lipidice există în stratul stratificat lipidic fluid și agregatele dinamice ale proteinelor. , a căror mobilitate este restricționată atât prin legături lipidă-lipidă, proteină-proteină sau proteină-lipidă, cât și prin interacțiunile proteinelor cu citoscheletul , cu matricea extracelulară sau cu celulele adiacente.
Fluiditatea membranei celulare
În condiții fiziologice , atât moleculele lipidice, cât și moleculele proteice scufundate în ele sunt capabile să se miște în propriul monostrat al membranei celulare. La temperaturi fiziologice, membrana celulară se află în stare lamelară lichid-cristalină, în care lanțurile hidrocarbonate ale lipidelor se află în stare fluidă, arătând astfel o libertate considerabilă de mișcare (starea L alfa a lui Luzzati). Dimpotrivă, în stare cristalină, lanțurile de hidrocarburi au un aranjament rigid, paralel cu perpendicularul pe suprafața stratului bistrat (L beta) sau unghiular față de acesta (L beta '). Temperatura la care are loc fuziunea lanțurilor alifatice, adică trecerea de la starea cristalină la cea lichid-cristalină, este definită ca temperatura de tranziție (Tc sau Temperatura critică sau Tm de la topire).
Majoritatea proteinelor prezintă mișcări de deplasare laterală (difuzie); proteinele de membrană ancorate la citoschelet sunt o excepție. În ceea ce privește lipidele membranei, au fost descrise diferite tipuri de mișcări, care pot fi intramoleculare (1) sau intermoleculare (2-4):
- Rotație în jurul legăturilor CC simple
- Rotația în jurul axei longitudinale
- Rotația în jurul axei transversale (rotația de 180 ° conduce la o mișcare a flip-flop-ului)
- Difuzie laterală
- Mișcări colective, cum ar fi ondularea membranei
Mișcarea intermoleculară are loc în principal în direcția orizontală (difuzie laterală), precum și în jurul axelor longitudinale și transversale ale moleculei (rotație și oscilație ), dar numai rareori se produce rotația transversală de 180 °, ceea ce determină trecerea moleculei printr-un monostrat către celălalt ( mișcare flip-flop ). De fapt, din punct de vedere termodinamic , este nefavorabil ca o moleculă polară să pătrundă cu capătul său hidrofil prin partea hidrofobă a stratului dublu; consumul de energie este mai mic în cazul unei molecule lipidice, dar și în acest caz mișcarea dintr-o parte a membranei în cealaltă are loc foarte lent. În membranele artificiale și naturale, o singură moleculă lipidică schimbă locurile cu cele vecine cu o frecvență de aproximativ 107 ori pe secundă și difuzează câțiva microni pe secundă la 37 ° C, cu un coeficient de difuzie (D) de aproximativ 10-8 cm² / s. Cu această rată de deplasare, o moleculă lipidică se poate difuza de-a lungul întregii celule bacteriene (~ 1 micron) în doar o secundă, în timp ce poate parcurge întreaga circumferință a unei celule animale în aproximativ 20 de secunde.
Mișcările intramoleculare constau în rotația în jurul legăturilor CC simple, ceea ce implică izomerizarea între diferitele conformații ale moleculei lipidice, în special izomerizarea trans-gauche . Mișcările de rotație ale grupărilor metil și izomerizarea trans-gauche sunt maxime spre centrul bistratului lipidic. Conformația trans este cea mai stabilă (conținut mai mic de energie), deoarece grupările metil sunt la distanța maximă una de cealaltă. La configurația all-trans (când toate grupările metil sunt în conformație trans), lanțul de hidrocarburi are lungimea maximă, deoarece molecula este complet extinsă, în timp ce prezența conformației gauche determină îndoirea moleculei. În starea cristalină (L beta), lanțurile alifatice ale fosfolipidelor sunt în conformație all-trans, odată cu creșterea temperaturii, excitația termică a lanțurilor favorizează izomerizarea trans-gauche. Deoarece procentul de conformații mari crește odată cu creșterea temperaturii, lanțurile de hidrocarburi ale fosfolipidelor sunt mai scurte la temperaturi ridicate.
Principalii factori care determină fluiditatea membranei celulare sunt, pe lângă temperatură:
- Lungimea acizilor grași;
- Gradul de nesaturare a acizilor grași ai cozilor fosfolipidelor;
- Caracteristicile capului polar;
- Concentrația colesterolului membranar.
În fosfogliceride există două tipuri de acizi grași: cei saturați , în care toate legăturile pe care le pot forma atomii de carbon sunt saturate cu atomi de hidrogen și cele nesaturate, în care se formează legături duble între atomii de carbon.
Fluiditatea bistratului lipidic se datorează parțial abundenței relative a acizilor grași nesaturați; în general, acidul gras din poziția 2 a fosfogliceridelor este nesaturat, cu toate acestea gradul de nesaturare variază în funcție de speciile de lipide, fiind fosfatidiletanolamină și fosfatidilserină (predominante în monostratul intern al membranei) mai nesaturate decât celelalte fosfolipide, în primul rând comparativ cu sfingomielina , care are aproximativ 70% acizi grași saturați.
Prezența lanțurilor nesaturate provoacă o tulburare mai mare în alinierea lanțurilor, făcând membrana mai fluidă, în timp ce lanțurile saturate cu aliniere mai compactă favorizează formarea unui rețea rigidă.
De fapt, legăturile duble cu configurație cis (care constituie configurația aproape tuturor acizilor grași naturali nesaturați) determină o îngenunchere a lanțului de hidrocarburi, astfel încât lungimea segmentelor paralele care interacționează cu moleculele vecine este redusă, obținând același efect ca scurtare a lanțului; efectul maxim apare atunci când legătura dublă ocupă poziția intermediară între capătul lanțului și glicerol : îndepărtând legătura dublă de poziția intermediară, lungimea segmentului paralel crește progresiv și interacțiunile cu lanțurile învecinate devin mai mari.
Dimpotrivă, legăturile duble din conformația trans au un efect mult mai redus asupra fluidității membranei, deoarece lanțul de hidrocarburi menține aproape aceeași conformație ca lanțurile saturate ( sfingozina are o legătură dublă trans).
Un alt factor care afectează fluiditatea membranei celulare este volumul ocupat de capul polar al fosfolipidelor, care este dependent de gradul său de hidrofilicitate. Volumul ocupat de capul hidratat în raport cu aria ocupată de cele două lanțuri de hidrocarburi influențează spațiul disponibil pentru mișcarea lanțurilor de hidrocarburi și, prin urmare, compactitatea alinierii lor. De exemplu, capetele de fosfatidiletanolamină ocupă puțin spațiu pentru formarea de legături de hidrogen între grupările -NH și -PO- 4 , în timp ce capetele de fosfatidilcolină , lipsite de grupuri donatoare, interacționează prin moleculele de apă legate, astfel încât zona ocupată de fiecare cap măsoară 47-54 Å, mult mai mult decât suprafața secțiunii ocupate de cele două lanțuri de hidrocarburi. Acest lucru determină o apropiere mai mică a lanțurilor de hidrocarburi, care pot forma astfel un număr mai mic de legături între ele. În consecință, acizii grași ai fosfatidilcolinei au o mai mare libertate de mișcare, astfel încât fluiditatea membranei este crescută.
Libertatea de mișcare a lanțului de hidrocarburi este exprimată prin parametrul S sau parametrul ordinii de orientare, care este o funcție a unghiurilor dintre perpendiculare pe membrană și axele x, y, z ale sistemului cartezian referitoare la grupul CH2 din examinare, astfel încât S = 1 înseamnă ordine și S = 0 tulburare.
Marcând atomii de C în poziții secvențiale de-a lungul lanțului de hidrocarburi cu deuteriu , tehnicile de rezonanță au arătat că cea mai mare mobilitate are loc la extremitatea cozilor de hidrocarburi și corespunde centrului bistratului, în timp ce cea mai mică mobilitate are loc în apropierea capului polar.
Natura capului polar influențează ordinea lanțului proximal de hidrocarburi, astfel încât mobilitatea este mai mică pentru etilen aminofosfolipide decât pentru colinofosfolide .
Ordinea lanțului este influențată și de prezența colesterolului și de gradul de saturație al lanțului și, bineînțeles, de temperatură.
Efectele colesterolului asupra fluidității membranei
Deși colesterolul este prea hidrofob pentru a forma laminate bimoleculare în dispersie pură, acesta contribuie totuși la structura membranei celulare prin intercalarea moleculelor de fosfolipide. Colesterolul este compus dintr-un inel tetraciclic ( ciclopentanoperhidrofenantren ), care constituie nucleul steroid, conținând o grupare hidroxil în poziția 3 și două grupări metil (C18 și C19) și un lanț lateral iso-octil. Colesterolul este introdus perpendicular în membrana celulară, astfel încât grupul său hidroxil să fie situat în exterior, în timp ce lanțul octilic este introdus în adâncimea membranei. Nucleul steroidic al colesterolului are o structură plană relativ rigidă și este asimetric în raport cu planul inelului tetraciclic, deoarece o față expune grupările metil, în timp ce cealaltă este netedă și fără substituenți. Partea buna a nucleului steroid vine în contact cu proximal CH 2 grupe (C1 - C10) ale lanțurilor alifatice saturate ale fosfolipide, în timp ce cealaltă parte, mai voluminoase, interacționează cu lanțurile nesaturate ale fosfolipide sau cu proteine membrana . Gruparea hidroxil din poziția 3 este în contact cu mediul extracelular apos, poziționându-se lângă capul polar al fosfolipidelor, în imediata vecinătate a grupului carboxilic esterificat al acizilor tapti.
Datorită acestei poziții, colesterolul reduce libertatea de mișcare a tractului proximal (mai aproape de glicerol) a lanțurilor de acizi grași, cu un efect redus asupra tractului distal, care ocupă centrul membranei celulare. De fapt, studiile de rezonanță au arătat că colesterolul crește ordinea segmentului proximal al lanțurilor alifatice, scăzând izomerizarea trans-gauche și îngenuncherea tranzitorie a lanțurilor în sine.
Prin urmare, datorită rigidității structurii sale, efectul colesterolului asupra fosfolipidelor, la temperaturi peste Tm, este de a crește ordinea tractului proximal al lanțurilor de acizi grași, în timp ce efectul asupra tractului distal, în centrul bistratul lipidic al membranei, este rar.
Dimpotrivă, la temperaturi sub Tm, efectul colesterolului este de a scădea ordinea lanțurilor alifatice ale acizilor grași și de a împiedica cristalizarea acestora, deoarece interferează cu interacțiunea CH 2- CH 2 dintre lanțurile hidrocarbonate ale fosfolipidelor.
Datorită conținutului mai mare de sfingolipide și colesterol, plutele au un grad de fluiditate mai mic decât celelalte regiuni ale membranei plasmatice. Ordinea mai mare a lanțurilor lipidice din plute duce la separarea acestor microdomenii de membrana rămasă în starea L-alfa cristalină-lichidă.
Noua fază care se formează prin efectul colesterolului asupra celorlalte lipide a fost numită de Zuckermann ( 1993 ) ordonată lichid sau lo, intermediară între faza cristalină și cea lichid-cristalină. Lanțurile de hidrocarburi din faza I sunt întinse și strâns împachetate, ca în faza cristalină, dar păstrează un grad ridicat de mobilitate laterală.
În amestecurile binare de colesterol cu un fosfolipid saturat (care are deci un Tm ridicat), deasupra fazei Tm o lo se separă de o fază lichid-cristalină, în timp ce sub Tm faza îl separă de faza cristalină.
Deoarece sfingolipidele au o saturație mai mare și un Tm mai mare, comparativ cu fosfogliceridele, conținutul mai ridicat în sfingolipide favorizează separarea domeniilor lo și, prin urmare, formarea plutelor.
În concluzie, ambalarea strânsă a lanțurilor de hidrocarburi este caracteristica cheie a existenței plutelor.
Având în vedere asimetria membranei, sfingolipidele sunt localizate în cea mai mare parte în pliantul exterior al stratului bistrat, astfel încât plută sunt probabil mai abundente în acest pliant. Cu toate acestea, formarea plutelor în foaia interioară este favorizată de fosfolipide care conțin etanolamină ( fosfatidiletanolamină și plasmeniletanolamină ), care datorită capului polar mic au o influență favorabilă asupra ambalării cozilor de hidrocarburi. Trebuie subliniat faptul că separarea de fază care are loc în plute favorizează partiția proteinelor prevăzute cu ancore saturate de lipide sau care, în orice caz, are o preferință pentru mediile lo. Din acest motiv plutele conțin proteine specifice.
O altă consecință a efectului colesterolului asupra acizilor grași fosfolipidici este creșterea grosimii membranei, datorită scăderii izomerizărilor trans-gauche și, prin urmare, tendinței segmentului proximal al lanțurilor alifatice de a-și asuma, de preferință, configurația trans., chiar dacă configurația all-trans tipică stării cristaline nu se manifestă niciodată. Cu toate acestea, pentru concentrațiile de colesterol peste 25%, lungimea lanțurilor este redusă datorită împachetării lanțurilor fosfolipidice ale foii opuse, care sunt dispuse în fața moleculelor de colesterol. Aceste perechi opuse colesterol-fosfolipide sunt mai scurte decât perechile opuse fosfolipid-fosfolipid.
Permeabilitatea membranei celulare
Membrana plasmatică este o barieră permeabilă selectiv între citoplasmă și mediul extracelular. Această caracteristică este o consecință a compoziției lipidice și proteice a membranei. Stratul bilateral fosfolipidic permite trecerea liberă a apei , gazelor (O 2 , CO 2 ) și a moleculelor liposolubile mici (fără încărcare), cum ar fi amoniacul , ureea , etanolul și glicerina , în timp ce proteinele de transport specifice asigură trecerea ionilor și solubile în apă (încărcate electric) molecule. Spre deosebire de ceea ce se întâmplă pentru compușii cu pm (greutate moleculară) scăzută, transportul macromoleculelor este un proces mult mai complex, care nu are loc exclusiv în membrana celulară, dar care afectează atât membrana plasmatică, cât și citoplasma și care necesită formarea de vezicule (transport vezicular), în interiorul căruia sunt conținute macromoleculele de transportat. Transportul vezicular este utilizat atât pentru transferul macromoleculelor extracelulare în celulă (endocitoză), ca în cazul lipoproteinelor cu densitate mică (LDL) sau a complexului Fe-transferrin, cât și pentru transportul compușilor intracelulari în mediul extracelular (exocitoză).
Difuzie pasivă
Trecerea prin componenta lipidică a membranei are loc prin difuzie pasivă simplă, în funcție de gradientul de concentrație dintre compartimentele intra- și extracelulare și fără consum de energie ( ATP ). Mișcarea moleculelor este direcționată din compartimentul cu cea mai mare concentrație către compartimentul cu cea mai mică concentrație și este influențată de dimensiunea și lipofilicitatea moleculei.
De exemplu, dietilurea , care este de 50 de ori mai hidrofobă decât ureea, se difuzează pe membrana celulară de 50 de ori mai rapid decât aceasta, în ciuda dimensiunilor sale mai mari. Conform teoriei kink mobile , trecerea moleculelor prin bistratul lipidic ar avea loc prin spațiile dintre lanțurile de acizi grași ai fosfolipidelor. Formarea acestor spații este favorizată de mobilitate, de izomerizarea trans-gauche și de prezența nesaturărilor, care provoacă o îndoială a acidului gras. În consecință, rezistența maximă la difuzie a moleculelor lipofile corespunde segmentului proximal al lanțurilor de acizi grași, care au o mobilitate mai mică (sau rigiditate mai mare), în timp ce rezistența cea mai mică corespunde segmentului terminal al lanțurilor, care, dimpotrivă, manifestă mobilitatea maximă.
Transport mediat de canalele proteice
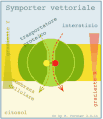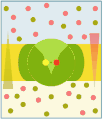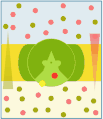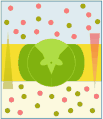
Majoritatea moleculelor traversează membrana plasmatică cu ajutorul proteinelor de transport. În plus față de moleculele solubile în apă, cum ar fi ureea, unele molecule liposolubile utilizează și transportul mediat de proteine, cu scopul de a le îmbunătăți trecerea, dacă sunt prezente nevoi funcționale particulare, așa cum se întâmplă în tubulii renali . Sunt recunoscute diferite tipuri de transport mediat de proteine: transportul pasiv , numit și difuzie facilitată, care are loc în funcție de gradient și, prin urmare, fără cheltuieli de energie, și transportul activ , care are loc împotriva gradientului și, prin urmare, cu cheltuielile de energie. Există trei tipuri de transport activ: uniporto , SimPort și portcullis . În uniporto există transportul unei singure specii de solut . În symport și în anti-port există transportul cuplat a două specii diferite de substanțe dizolvate: în symport transportul celor două substanțe dizolvate are loc în aceeași direcție, în timp ce în anti-port are loc în direcția opusă. Transportul activ poate fi împărțit în primar sau secundar, pe baza modului în care este produsă energia necesară transportului.
Transport pasiv
În transportul pasiv, trecerea unei molecule solubile în apă (uniport) are loc prin difuzie în funcție de gradientul de concentrație și, în cazul moleculelor încărcate electric, de asemenea, în funcție de gradientul electric . Cu toate acestea, spre deosebire de ceea ce se întâmplă în difuzia pasivă a moleculelor liposolubile, în acest caz difuzarea este facilitată de intervenția proteinelor. Două clase de proteine sunt responsabile pentru transportul pasiv, purtători și canale .
Purtătorii mediază transportul glucidelor, aminoacizilor și nucleozidelor . Odată ce solutul este legat în compartimentul cu concentrație ridicată, purtătorul suferă o schimbare conformațională care permite transferul solutului în compartimentul cu concentrație scăzută.
În cazul canalelor , proteinele formează pori în membrana plasmatică, care permit difuzarea ionilor sau a moleculelor mici solubile în apă cu greutate moleculară adecvată și sarcină electrică . Aquaporinele , care favorizează trecerea moleculelor de apă, fac parte din canale.
Deschiderea canalelor poate fi reglată prin receptori (canale ROC - Receptor Operated canale ), prin mesagerilor secundari (canale smoc sau al doilea Messenger Canale Operat ) sau de potențialul electric al membranei (canale COV sau Canalelor Voltage Operated ), astfel încât pasajul poate fi fin modulat. Un exemplu clar în acest sens este familia complexă a canalelor de calciu , a cărei complexitate este legată de rolul decisiv pe care îl are calciul intracelular în controlul unei game largi de funcții celulare. Canalele joncțiunilor gap permit trecerea moleculelor de la o celulă la alta.
Transport activ
În transportul activ primar , proteinele transportă substanțe dizolvate împotriva gradientului electrochimic , folosind energia obținută din hidroliza ATP, astfel încât aceste proteine să fie dotate cu activitate enzimatică (ATPaza). Pompele transportă ioni, în timp ce transportorii ABC (casete care leagă ATP) transportă o gamă largă de molecule, inclusiv carbohidrați, aminoacizi și ioni. Legarea ATP de proteina de transport permite schimbarea conformațională necesară pentru transferul solutului.
În transportul activ secundar , energia necesară pentru transportul unui dizolvat împotriva gradientului său de concentrație nu este furnizată direct de ATP, ci de existența unui gradient electrochimic de Na + (sau H + ) produs de pompa ionică respectivă. Transportul activ secundar este deci cuplat indirect cu un sistem de transport activ primar, care generează gradientul electrochimic.
Prin urmare, în transportul activ secundar există transportul cuplat a două specii diferite de substanțe dizolvate: Na + (sau H + ) este transportat pasiv din mediul cu concentrație ridicată în compartimentul cu concentrație scăzută, în timp ce celălalt soluție este transportat, întotdeauna pasiv, împotriva gradientului de concentrație de la concentrația scăzută către compartimentul de concentrație mare, exploatând gradientul electric favorabil generat de transportul ionului cuplat. În simporto (cotransport) transportul celor două substanțe dizolvate are loc în aceeași direcție, în timp ce în antiport (schimb) are loc în direcția opusă. De asemenea, în acest caz, transferul solutului are loc datorită schimbării conformaționale a proteinei transportoare, care este indusă de legarea solutelor în sine.
Un exemplu de transport activ secundar este cel al glucozei din celulele epiteliale ale intestinului. O proteină membranară numită cotransportor Na + / glucoză folosește gradientul de sodiu pentru a transporta glucoza împotriva gradientului.
Funcții
Membrana celulară prezidează homeostazia celulară, datorită permeabilității sale selective.
Datorită poziției sale de interfață, membrana plasmatică, pe lângă funcția sa structurală, îndeplinește și alte funcții esențiale:
- Funcția de izolare fizică, deoarece reprezintă o barieră între fluidul intracelular și fluidul extracelular.
- Funcția de filtrare selectivă, care lasă mai degrabă să treacă unele substanțe decât altele, asigurând astfel integritatea biochimică a citoplasmei ;
- Funcția suprafeței de comunicare, permițând atât schimbul de informații între mediul intra și extracelular, cât și interacțiunea fizică cu structurile extracelulare înconjurătoare.
- Funcția de suprafață catalitică , dat fiind numărul abundent de enzime legate de aceasta, implicată în mare măsură în producția de mesageri intracelulari, cum ar fi fosfolipazele și sfingomielinazele , care hidrolizează fosfolipidele de membrană și adenilciclaza , care sintetizează AMP ciclic .
- Funcția de susținere structurală, prin intermediul proteinelor de membrană ancorate la citoschelet și la joncțiunile celulare, menține forma celulei.
Infine, la membrana cellulare partecipa a funzioni complesse: esocitosi (secrezione), endocitosi (ingestione di sostanze esterne mediante la formazione di vescicole), adesione e movimento cellulare ameboide (es. leucociti).
La struttura e le funzioni della membrana plasmatica sono comuni a quelle delle membrane intracellulari, come ad esempio la membrana nucleare .
Note
- ^ Gerald Karp: Cell and molecular biology, 2010, 6th ed.
Bibliografia
- Alberts, Bruce: Molecular Biology of the Cell , 2002 4th ed; 2008 5th ed.
- Yeagle, Philip: The Structure of Biological Membranes, 2005, 2th ed.
Modello a mosaico fluido
- Singer, SJ, and GL Nicolson. 1972. The fluid mosaic model of the structure of cell membranes. Science. 175:720-731.
- Simons, K., E. Ikonen. 1997. Functional rafts in cell membranes. Nature. 387:569–572
- Parton, RG 1996. Caveolae and caveolins. Curr. Opin. Cell Biol. 8:542–548.
- Harder, T., and K. Simons. 1997. Caveolae, DIGs, and the dynamics of sphingolipid-cholesterol microdomains. Curr. Opin.Cell Biol. 9:534–542.
- Brown, DA, E. London. 1998. Functions of lipid rafts in biological membranes. Annu. Rev. Cell Dev. Biol 14:111–136
- Brown, DA, and E. London. 1998. Structure and origin of ordered lipid domains in biological membranes. J. Membr. Biol. 164:103–114.
- Simons, K., and D. Toomre. 2000. Lipid rafts and signal transduction. Nat. Rev. Mol. Cell Biol. 1:31–39.
- Zhi-Jie Cheng. 2006. Membrane microdomains, caveolae, and caveolar endocytosis of sphingolipids. Molecular Membrane Biology, 23:101-110.
- Quinn, Peter J. 2011. A lipid matrix model of membrane raft structure. Progress in Lipid Research 49:390–406.
Fluidità della membrana cellulare ed effetti del colesterolo
- Luzzati, V. 1968. X-ray diffraction studies of lipid-water systems. In Biological Membranes, vol 1. Edited by Chapman D. New York. Academic Press.
- Luzzati, V. 1974. Order-Disorder Conformational Transitions of the Hydrocarbon Chains of Lipids. J. Mol. Biol. 85:249-277.
- Seelig, A. 1974. The dynamic structure of fatty acyl chains in a phospholipid bilayer measured by deuterium magnetic resonance. Biochemistry. 13:4839-4845.
- Bloch, KE 1983. Sterol structure and membrane function, CRC Crit. Rev. Biochem. 14:47–92.
- Small, DM 1986. The physical chemistry of lipids. In The Handbook of Lipid Research, vol. 4. DJ Hanahan, series editor. Plenum Press, New York.
- Boggs, Joan M. 1987.Lipid intermolecular hydrogen bonding: influence on structural organization and membrane function Biochimica et Biophysica Acta 906:353-404.
- Tate, MW, and SM Gruner. 1987. Lipid polymorphism of dioleoylphosphatidylethanolamine and saturated and monounsaturated phosphatidylcholines of various chain lengths. Biochemistry. 26:231–236.
- Marsh, D. 1990. Handbook of Lipid Bilayers. CRC Press, Boca Raton.
- Seddon, JM 1990. Structure of the inverted hexagonal (HII) phase, and non-lamellar phase transitions in lipids. Biochim. Biophys. Acta. 1031:1–69.
- Yeagle, PL. 1991. Modulation of membrane function by cholesterol. Biochimie. 73:1303-1310.
- Mouritsen OG, Zuckermann MJ. 2004. What's so special about cholesterol? Lipids 39:1101–13.
- Pöyry, S. 2008. Significance of cholesterol methyl groups. J. Phys. Chem. B 112:2922–2929.
- Quinn, Peter J. 2009. The liquid-ordered phase in membranes. Biochimica et Biophysica Acta 1788:33–46
- Marsh, Derek. 2010. Molecular volumes of phospholipids and glycolipids in membranes. Chemistry and Physics of Lipids. 163:667–677.
- Chaudhuri, A. 2011. Transbilayer organization of membrane cholesterol at low concentrations. Biochimica et Biophysica Acta 1808:19–25.
Permeabilità della membrana cellulare
- Arguello, JM Metal Transport across Biomembranes: Emerging Models for a Distinct Chemistry. (2012). J. Biol. Chem. 287:13510-13517.
- Nagle, JF, Mathai, jC (2008). Theory of Passive Permeability through Lipid Bilayers. J Gen Physiol. 131:77-85.
- Mathai, JC (2008). Structural Determinants of Water Permeability through the Lipid Membrane. J Gen Physiol. 131:69-76.
- Linton, KJ (2007). Structure and Function of ABC Transporters. Physiology. 22:122-130.
- Scheiner-Bobis, G. (2000). The sodium pump: Its molecular properties and mechanics. Eur. J. Biochem. 269:2424–2433.
- Pao S. (1998). Major Facilitator Superfamily. Microbiol. Mol. Biol. Rev. 62:1–34.
- Orlowski, J. (1997). Na+/H+ Exchangers of Mammalian Cells. J. Biol. Chem. 272:22373-22376.
- Haines, TH (1994). Water transport across biological membranes. FEBS Lett. 346:115–122.
Voci correlate
Altri progetti
-
 Wikizionario contiene il lemma di dizionario « membrana cellulare »
Wikizionario contiene il lemma di dizionario « membrana cellulare » -
 Wikiversità contiene risorse sulla membrana cellulare
Wikiversità contiene risorse sulla membrana cellulare -
 Wikimedia Commons contiene immagini o altri file sulla membrana cellulare
Wikimedia Commons contiene immagini o altri file sulla membrana cellulare
Collegamenti esterni
- ( EN ) Membrana cellulare , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 35472 · LCCN ( EN ) sh85021654 · GND ( DE ) 4067550-6 · BNF ( FR ) cb11958886k (data) · NDL ( EN , JA ) 00569973 |
|---|