Iodometan
| Iodometan | |
|---|---|
| Numele IUPAC | |
| iodometan | |
| Denumiri alternative | |
| iodură de metil | |
| Caracteristici generale | |
| Formula moleculară sau brută | CH 3 I |
| Masa moleculară ( u ) | 141,94 |
| Aspect | lichid incolor cu miros acru |
| numar CAS | |
| Numărul EINECS | 200-819-5 |
| PubChem | 6328 |
| ZÂMBETE | CI |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 2.28 |
| Indicele de refracție | 1.531 |
| Solubilitate în apă | 14 g / L (20 ° C) |
| Temperatură de topire | −66,5 ° C (206,65 K) |
| Temperatura de fierbere | 42,5 ° C (315,65 K) |
| Presiunea de vapori ( Pa ) la 293,15 K. | 50.000 |
| Proprietăți toxicologice | |
| LD 50 (mg / kg) | 76 (oral, șobolan) |
| Informații de siguranță | |
| Punct de flacără | −28 ° C (245,15 K) |
| Simboluri de pericol chimic | |
  | |
| Pericol | |
| Fraze H | 301 - 312 - 315 - 331 - 335 - 351 |
| Sfaturi P | 261 - 280 - 301 + 310 - 311 [1] |
Iodometanul , numit și iodură de metil , este un compus chimic obținut prin înlocuirea unui atom de hidrogen de metan cu unul de iod . La temperatura camerei apare ca un lichid incolor miscibil în solvenți organici . În natură este eliberat în cantități mici din plantațiile de orez . [2] Este utilizat în sinteza organică ca agent de metilare și se propune utilizarea acestuia în agricultură ca agent fumigant în locul bromometanului , [3] interzis prin protocolul de la Montreal .
Sinteză
Iodometanul este sintetizat prin reacția metanolului cu triiodura de fosfor , obținută in situ folosind iod și fosfor roșu: [4]
O metodă de sinteză alternativă exploatează reacția dintre sulfatul de dimetil și iodura de potasiu în prezența carbonatului de calciu : [4]
Iodometanul poate fi purificat prin distilare și spălare ulterioară cu tiosulfat de sodiu pentru a elimina urmele de iod.
O altă metodă de sinteză folosește metanol și iodură de potasiu în prezența acidului sulfuric :
Reacția se desfășoară la o temperatură scăzută și apa produsă este absorbită de excesul de acid sulfuric, deplasând astfel echilibrul spre dreapta. Iodometanul obținut poate fi distilat din amestecul de reacție.
Reacții
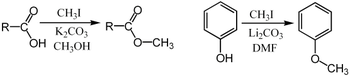
Iodometanul este un substrat excelent pentru reacțiile S N 2 , steric puțin împiedicat și cu iod care constituie un grup bun de părăsire . Se folosește pentru a alchila nucleofili care conțin atomi de carbon, oxigen, sulf, azot și fosfor. [5] De exemplu, poate fi utilizat pentru metilarea fenolilor și a acizilor carboxilici : [6]
Un alt exemplu este reprezentat de metilarea amoniacului , cu formarea derivaților aminelor (ioduri de metilamoniu):
Lodometan poate fi folosit ca precursor al Grignard reactiv CH3 Mgl, a căror utilizare a fost oarecum înlăturată de disponibil comercial methylthium .
În procesul Monsanto , iodura de metil se formează in situ prin reacția dintre metanol și iodură de hidrogen . Ulterior CH 3 I reacționează cu monoxid de carbon în prezența unui rodiu complex care formează ch3 COI ( acetil iodura ), care după hidroliză produce acid acetic .
Toxicitate
Iodometanul are un LD50 oral la șobolani de 76 mg / kg și se transformă rapid în S-metil glutation în ficat . [7] Este clasificat ca potențial cancerigen de către diferite agenții active în domeniile medical și de mediu. IARC îl plasează în categoria 3 (clasificare imposibilă în ceea ce privește acțiunea cancerigenă pentru oameni).
Inhalarea vaporilor de iodometan poate provoca leziuni ale plămânilor , ficatului, rinichilor și sistemului nervos . Provoacă greață , amețeli, tuse și vărsături . Contactul prelungit cu pielea provoacă arsuri . Inhalarea masivă poate provoca edem pulmonar .
Toxicitatea sa derivă din acțiunea sa puternică de metilare: enzimele care conțin grupări sulfhidril -SH sunt afectate în special de efectul acestui tip de substanță și sunt inhibate. Sistemul nervos central este deosebit de afectat, unde lipsa acestor enzime provoacă daune grave.
Notă
- ^ Sigma-Aldrich; rev. din 13.05.2014
- ^ KR Redeker, N.-Y. Wang, JC Low, A. McMillan, SC Tyler și RJ Cicerone, Emisiile de halogenuri de metil și metan din orezele , în Știință , vol. 290, nr. 5493, 2000, pp. 966–969, DOI : 10.1126 / science.290.5493.966 , PMID 11062125 .
- ^ (EN) Marla Cone, EPA OKs utilizare de pesticide toxice pe câmpuri , în Los Angeles Times, 6 octombrie 2007. Accesat la 4 martie 2011.
- ^ a b King, CS; Hartman, WW (1943), Iodură de metil Arhivat 5 iunie 2011 la Internet Archive .; Org. Sintetizator. , Col. Vol. 2 : 399
- ^ Sulikowski, Gary A.; Sulikowski, Michelle M.; Haukaas, Michael H.; Luna, Bongjin (2005). „Iodometan”. e-EROS . DOI : 10.1002 / 047084289X.ri029m.pub2
- ^ Avila-Zárraga, JG, Martínez, R., Metilarea eficientă a acizilor carboxilici cu hidroxid de potasiu / metil sulfoxid și iodometan , în Synthetic Communications , vol. 31, n. 14, ianuarie 2001, pp. 2177-2183, DOI : 10.1081 / SCC-100104469 .
- ^ Johnson, MK, Metabolismul iodometanului la șobolan , în Biochem. J., voi. 98, 1966, pp. 38–43, PMID 5938661 .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe iodometan
Wikimedia Commons conține imagini sau alte fișiere pe iodometan
| Controlul autorității | LCCN (EN) sh2011000498 · GND (DE) 4298750-7 |
|---|