Inhibitor ireversibil
Inhibitorii ireversibili sunt inhibitori enzimatici care se leagă sau distrug covalent un grup funcțional al enzimei esențiale pentru activitatea sa.
Tipuri
Inhibitorii ireversibili modifică de obicei covalent enzima și, prin urmare, inhibarea nu poate fi ulterior neutralizată. Adesea, astfel de inhibitori conțin grupe funcționale reactive , cum ar fi aldehide , haloalcani sau alchene . Aceste grupări electrofile reacționează cu lanțurile laterale ale aminoacizilor pentru a forma aducte covalente. Reziduurile modificate sunt cele cu lanțuri laterale care conțin grupări nucleofile cum ar fi hidroxil sau sulfhidril (de exemplu, serină , care poate fi vizată de diizopropilfluorofosfat , cisteină , treonină sau tirozină ). [1]
Conceptul de inhibiție ireversibilă este în orice caz diferit de cel de inactivare ireversibilă a enzimei. Inhibitorii ireversibili sunt de obicei specifici unei clase de enzime și nu inactivează toate proteinele; acestea nu funcționează prin distrugerea structurii proteinelor, ci prin modificarea specifică a sitului activ al țintei lor. Prin urmare, inhibitorii ireversibili nu sunt legați de fenomene legate de pH-ul sau nivelurile extreme de temperatură , care cauzează de obicei denaturarea nespecifică a tuturor structurilor proteice prezente în soluție, sau de hidroliza nespecifică mediată prin adăugarea de acid clorhidric în concentrat mediu, fierbinte, care generează o rupere a legăturilor peptidice și eliberarea de aminoacizi liberi . [2]
Analiza de inhibare ireversibilă
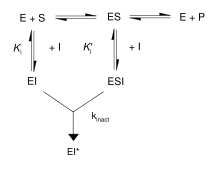
Inhibitorii ireversibili formează un complex reversibil non-covalent cu enzima (EI sau ESI), care reacționează pentru a produce un complex modificat și definit covalent EI * sau impas (fără ieșire). Raportul la care se formează EI * se numește raportul de inactivare (sau k inact ). Deoarece formarea EI poate concura cu ES, legarea inhibitorilor ireversibili poate fi evitată prin concurența cu un substrat sau un al doilea inhibitor reversibil.
Mecanismele de legare și inactivare ale acestui tip de reacție pot fi investigate prin incubarea enzimei și a inhibitorului și măsurarea cantității de activitate rămasă în timp. Activitatea scade într-o manieră dependentă de timp, de obicei după decăderea exponențială . Plasarea acestor date într-o ecuație de raport conduce la o rată de inactivare la concentrația respectivă de inhibitor. Această operație se repetă la diferite concentrații ale inhibitorului. Dacă este implicat un complex EI reversibil, rata de inactivare va fi saturabilă și, trasând curba, se vor obține k inact și K i . [3]
O altă metodă utilizată pe scară largă în aceste analize este spectrometria de masă . În acest caz, o măsurare precisă a masei enzimei nemodificate originale și a enzimei inactivate permite calcularea creșterii masei cauzată de reacția cu inhibitorul și arată stoichiometria reacției. Acest lucru poate fi investigat folosind un spectrometru de masă MALDI- TOF. O tehnică complementară, amprenta proteică , implică digerarea proteinei originale și modificate folosind o protează, cum ar fi tripsina . Aceasta produce un set de peptide care pot fi analizate cu un spectrometru de masă. Peptida a cărei masă se modifică după reacția cu inhibitorul este cea care conține locul modificării.
Cazuri speciale

Adesea, unii inhibitori reversibili sunt capabili să se lege atât de strâns de ținta lor încât să pară ireversibili. Acești inhibitori prezintă constante cinetice similare cu cele ale inhibitorilor covalenți ireversibili. În aceste cazuri, unii dintre acești inhibitori se leagă rapid de enzimă în complexul EI cu afinitate scăzută și acesta suferă ulterior o reajustare mai lentă la un complex EI * foarte strâns legat. Acest comportament cinetic se numește legare lentă [5] Această stabilizare lentă după legare determină adesea o schimbare a conformației, legată de faptul că enzima se strânge în jurul moleculei inhibitoare. Exemple de inhibitori de legare lentă sunt medicamente importante, cum ar fi metotrexatul [6] , alopurinolul [7] și forma activată a aciclovirului . [8]
Exemple de inhibitori ireversibili

Diizopropilfluorofosfatul (DFP) este un inhibitor de protează, care hidrolizează legătura fosfor - fluor lăsând fosfatul legat de serina prezentă în situsul activ , inhibând ireversibil enzima. [9] În mod similar, DFP reacționează și cu situl activ al acetilcolinesterazei în sinapsele neuronilor și, prin urmare, este, de asemenea, o neurotoxină puternică, a cărei doză letală este stabilită la mai puțin de 100 mg. [10]
Un alt exemplu de inhibitor ireversibil al proteazei este iodoacetamida, care se leagă de un reziduu de cisteină al enzimei. Sulful conținut în aminoacid reacționează cu acest inhibitor, se formează un tioeter , eliberând acid hipohidric (HI). Enzima își pierde apoi activitatea.
Inhibarea sinuciderii este un tip neobișnuit de inhibiție ireversibilă care apare atunci când enzima transformă inhibitorul într-o formă reactivă la locul său activ. Un exemplu este α-difluorometilornitina (sau DFMO), un inhibitor al biosintezei poliaminei și un analog al aminoacidului ornitină , utilizat pentru tratarea tripanosomiazei africane (febra somnului). Ornitina decarboxilaza poate cataliza decarboxilarea DFMO în loc de ornitină. Consecința acestei reacții este eliminarea unui atom de fluor, care transformă acest intermediar catalitic în imină conjugată, o specie foarte electrofilă, care reacționează cu un reziduu de cisteină sau lizină din situsul activ pentru a inhiba ireversibil enzima. [4]
Deoarece inhibiția ireversibilă are ca rezultat adesea formarea inițială a unui complex EI non-covalent, este uneori posibil ca un inhibitor să se lege de o enzimă în mai multe moduri. De exemplu, un inhibitor numit muștar chinacrin poate inhiba trypanothione reductaza protozoarului Trypanosoma cruzi în două moduri diferite. Într-un caz se poate lega reversibil, în celălalt covalent, deoarece reacționează cu un reziduu de aminoacizi prin azoipritul său. [11]
Inhibitori de sinucidere
Clasa specială de inhibitori ireversibili.
Notă
- ^ Reactivi chimici Lundblad RL pentru modificarea proteinelor CRC Press Inc (2004) ISBN 0-8493-1983-8
- ^ N. Price, B. Hames, D. Rickwood (Ed.) Proteins LabFax Academic Press (1996) ISBN 0-12-564710-7
- ^ Maurer T, Fung HL. Comparația metodelor pentru analiza datelor cinetice din inactivarea enzimatică bazată pe mecanism: aplicație la sintaza oxidului nitric. AAPS PharmSci. (2000) 2 (1) E8. PMID 11741224
- ^ a b Poulin R, Lu L, Ackermann B, Bey P, Pegg AE. Mecanismul inactivării ireversibile a decarboxilazei ornitinei de șoarece de către alfa-difluorometilornitină. Caracterizarea secvențelor la situsurile de legare a inhibitorului și coenzimei. Arhivat la 24 ianuarie 2009 la Internet Archive . J Biol Chem. 1992 5 ianuarie; 267 (1): 150-8. PMID 1730582
- ^ Szedlacsek, SE și Duggleby, RG Cinetica inhibitorilor de legare lentă și strânsă. Meth. Enzymol., (1995) 249: 144-180. PMID 7791610
- ^ Stone SR, Morrison JF. Mecanismul de inhibare a dihidrofolatului reductazelor din surse bacteriene și vertebrate de diferite clase de analogi de folat. Biochim Biophys Acta. 1986 14 februarie; 869 (3): 275-85. PMID 3511964
- ^ Hille R, Massey V. Inhibitori de legare strânși ai xantin oxidazei. Pharmacol Ther. 1981; 14 (2): 249-63. PMID 4322209
- ^ Reardon JE. Virusul Herpes simplex tip 1 și interacțiunile ADN polimerazei umane cu analogi de 2'-deoxiguanozină 5'-trifosfat. Cinetica încorporării în ADN și inducerea inhibiției. Arhivat la 24 ianuarie 2009 la Internet Archive . J Biol Chem. 1989 15 noiembrie; 264 (32): 19039–44. PMID 2553730
- ^ JA Cohen, RA Oosterbaan și F. Berends Compuși organofosforici Meth. Enzimol. (1967) 11, 686
- ^ Brenner, GM (2000): Farmacologie. Philadelphia, PA: Compania WB Saunders. ISBN 0-7216-7757-6
- ^ Saravanamuthu A, Vickers TJ, Bond CS, Peterson MR, Hunter WN, Fairlamb AH. Două site-uri de legare care interacționează pentru derivații chinacrinei în situsul activ al trypanothione reductazei: un șablon pentru proiectarea medicamentelor. Arhivat la 12 mai 2009 la Internet Archive . J Biol Chem. 2004 9 iulie; 279 (28): 29493-500. PMID 15102853
Bibliografie
- David L. Nelson, Michael M. Cox, Principiile de biochimie ale lui Lehninger , ediția a III-a, Bologna, Zanichelli , februarie 2002, ISBN 88-08-09035-3 .
Elemente conexe
- Inhibitor enzimatic
- Inhibitor reversibil
- Inhibitor competitiv
- Inhibitor necompetitiv
- Inhibitor competitiv
- Inhibitor de tip mixt
- Inhibarea enzimelor retroactive din produsul final
- Inhibitor de sinucidere
- Enzimă
- Cataliza enzimatică
- Reglarea alosterică
- Site activ
- Cinetica Michaelis-Menten
- Constanta Michaelis-Menten
linkuri externe
- ( EN ) Tutorial web despre inhibarea enzimelor , fișă de Peter Birch de la Universitatea din Paisley, cu animații
- (EN) Simbolism și terminologie în cinetica enzimatică , sfaturi privind terminologia inhibării enzimelor de către Comitetul de nomenclatură al Uniunii Internaționale de Biochimie (NC-IUB)
- ( EN ) PubChem de la NCBI , baza de date cu medicamente și inhibitori enzimatici
- ( EN ) BRENDA , bază de date de enzime cu inhibitori cunoscuți înrudiți
- (EN) Enzime, cinetică și diagnostic Utilizați text despre aplicațiile medicale ale inhibitorilor enzimatici Michael W. King de la Școala de Medicină IU