Clorură de niobiu (V)
| Clorură de niobiu (V) | |
|---|---|
| Denumiri alternative | |
| pentaclorură de niobiu | |
| Caracteristici generale | |
| Formula moleculară sau brută | NbCl 5 |
| Masa moleculară ( u ) | 270,17 |
| Aspect | solid galben deliquescent |
| numar CAS | |
| Numărul EINECS | 233-059-8 |
| PubChem | 24818 |
| ZÂMBETE | Cl[Nb](Cl)(Cl)(Cl)Cl |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 2,74 |
| Solubilitate în apă | se descompune |
| Temperatură de topire | 205 ° C (478 K) |
| Temperatura de fierbere | 254 ° C (527 K) |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | −797 |
| S 0 m (J K −1 mol −1 ) | 214 |
| Proprietăți toxicologice | |
| LD 50 (mg / kg) | 1400 șobolan oral |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
  | |
| Fraze H | 302, 314 |
| Sfaturi P | 260, 301 + 330 + 331, 303 + 361 + 353, 305 + 351 + 338, 405, 501 |
Clorura de niobiu (V) sau pentaclorura de niobiu este compusul anorganic cu formula NbCl 5 . În condiții normale, este un solid cristalin galben deliquescent, care se hidrolizează rapid în contact cu apa. În acest compus, niobiul se află în starea de oxidare +5. Este folosit ca precursor al altor compuși niobi.
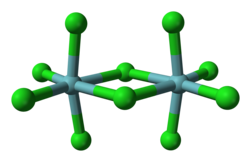
Structura
În stare solidă, structura constă din dimeri cu punți de clor. Se cunosc diverse polimorfe. [1] În structura cristalină a polimorfului α fiecare centru de niobiu este hexacoordonat, cu o geometrie octaedrică semnificativ distorsionată. Pe planul ecuatorial, distanțele terminale ale legăturii niobiu-clor sunt de 225 µm , în timp ce distanțele de punte sunt de 256 µm. Distanțele axiale niobiu-clor sunt 229,2 µm, iar axele sunt înclinate spre interior formând un unghi de 83,7 ° față de planul ecuatorial al moleculei. Unghiul punții Nb - Cl - Nb este de 101,3 °. Distanța Nb - Nb este de 398,8 pm, prea lungă pentru a fi posibilă orice interacțiune între cele două metale. [2] NbBr 5 , TaCl 5 și TaBr 5 sunt izostructurale cu NbCl 5 ; NbI 5 și TaI 5 , pe de altă parte, au structuri diferite.
În stare gazoasă NbCl 5 este monomeric, cu o structură bipiramidică trigonală și simetrie moleculară D 3h . [3]
Sinteză
Industrial NbCl 5 se obține prin clorurare directă la 500-600 ° C a aliajelor metalice de niobiu sau fier / niobiu (care pot conține, de asemenea, tantal și alte metale). NbCl 5 este izolat și purificat prin distilare. [4]
In laborator NbCl 5 este adesea preparat din oxid de Nb 2 O 5 ; principala problemă este reacția incompletă cu formarea de oxihalide precum NbOCl 3 . Conversia poate fi efectuată cu clorură de tionil . [5] NbCl 5 poate fi de asemenea preparate prin clorurarea Nb 2 O 5 în prezență de carbon la 300 ° C, dar , de asemenea , în acest caz , produsele pot conține NbOCl 3. Sunt posibile și alte proceduri. [6] În cele din urmă NbCl 5 poate fi purificat prin sublimare. [1]
Reactivitate
NbCl 5 este un compus stabil, dar higroscopic și deliquescent. Este un acid Lewis puternic, dar mai puțin decât fluorura de NbF 5 corespunzătoare. În apă se hidrolizează rapid, formând oxid clorhidric și acid clorhidric. Se dizolvă în solvenți organici , cum ar fi coordonarea non eter și CCI4 menținerea structurii dimerice. În solvenții de coordonare formează aducti precum NbCl 5 L și NbCl 5 L 2 . Cu clorurile metalelor alcaline (MCl) reacționează pentru a forma M + NbCl 6 - . [1] [3]
Utilizări
NbCl 5 este cel mai utilizat precursor pentru sinteza altor compuși de niobiu, inclusiv alcoxizi , care găsesc o utilizare de nișă în procesele sol-gel . În chimia organică este un acid Lewis pentru uz specializat, util pentru activarea alchenelor în reacția carbonil-ene și în reacția Diels-Alder .
Informații de siguranță
NbCl 5 este disponibil comercial. Compusul este dăunător dacă este ingerat, inhalat sau în contact cu pielea. La contact provoacă arsuri severe ale pielii și leziuni oculare grave. Nu există date care să indice proprietăți cancerigene. Nu este considerat foarte periculos pentru apă și mediu. [7]
Notă
- ^ a b c Cotton și colab. 1999 , p. 899 .
- ^ Cotton și colab. 1991
- ^ a b Hubert-Pfalzgraf 2006
- ^ Eckert 2002
- ^ Brown 1957
- ^ Brauer 1965 , p. 1302 .
- ^ Alfa Aesar, NbCl 5 Fisa cu date de securitate.
Bibliografie
- ( EN ) G. Brauer (ed.), Handbook of Preparative Inorganic Chemistry , vol. 2, New York, Academic Press, 1965.
- D. Brown, clorură de niobiu (V) și hexacloroniobați (V) , în Inorg. Sintetizator. , vol. 9, 1957, pp. 88–92, DOI : 10.1002 / 9780470132401.ch24 .
- FA Cotton, PA Kibala, M. Matusz și RBW Sandor, Structura celui de-al doilea polimorf al pentaclorurii de niobiu , în Acta Cryst. , C47, 1991, pp. 2435-2437, DOI : 10.1107 / S0108270191000239 . Adus la 30 martie 2012 .
- ( EN ) FA Cotton, G. Wilkinson, CA Murillo și M. Bochmann,Advanced Inorganic Chemistry , ediția a VI-a, Wiley-Interscience, 1999, ISBN 978-0-471-19957-1 .
- ( EN ) J. Eckert, Niobium and Niobium Compounds , în Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, 2002, DOI : 10.1002 / 14356007.a17_251 .
- ( EN ) LG Hubert-Pfalzgraf, Niobium & Tantalum: Inorganic & Coordination Chemistry , în Enciclopedia chimiei anorganice , ediția a II-a, John Wiley & Sons, 2006, DOI : 10.1002 / 0470862106.ia153 , ISBN 978-0-470-86210 -0 .