Trioxid de tungsten
| Trioxid de tungsten | |
|---|---|
| Numele IUPAC | |
| Trioxid de tungsten | |
| Denumiri alternative | |
| Anhidridă tungstică Tungsten (VI) Oxid de tungsten | |
| Caracteristici generale | |
| Formula moleculară sau brută | WO 3 |
| Masa moleculară ( u ) | 231,84 g / mol |
| Aspect | Pulbere galbenă |
| numar CAS | |
| Numărul EINECS | 215-231-4 |
| PubChem | 14811 |
| ZÂMBETE | O=[W](=O)=O |
| Proprietăți fizico-chimice | |
| Solubilitate în apă | insolubil |
| Temperatură de topire | 1746 |
| Temperatura de fierbere | ~ 1970 |
| Informații de siguranță | |
| Fraze H | --- |
| Sfaturi P | --- [1] |
Oxidul de tungsten (VI) (cunoscut și sub numele de trioxid de tungsten sau anhidridă tungstică ) este un compus chimic care conține oxigen și tungsten (un metal de tranziție ), având formula moleculară WO 3 .
Se obține în reacția de recuperare a tungstenului din mineralele sale. [2] Minereurile de tungsten sunt tratate cu compuși alcalini pentru a produce WO 3 . O reacție ulterioară cu carbon sau hidrogen gazos reduce trioxidul de tungsten la metal pur.
- 2 WO 3 + 3 C + căldură → 2 W + 3 CO 2
- WO 3 + 3 H 2 + căldură → W + 3 H 2 O
Trioxidul de tungsten (VI) apare în mod natural sub formă de hidrați , care includ mineralele: tungstit WO 3 H 2 O, meimacit WO 3 2H 2 O și hidrotungstit (cu aceeași compoziție ca meimacit, însă uneori scris ca H 2 WO 4 ) . Aceste minerale sunt foarte rare.
Istorie
Tungstenul are o istorie bogată începând cu descoperirea sa în secolul al XVIII-lea . Peter Woulfe a fost primul care a recunoscut un element nou în wolframitul mineral natural. Tungstenul a fost, de fapt, cunoscut inițial sub numele de "wolfram" (de aici și simbolul său "W"). Chimistul suedez Carl Wilhelm Scheele a contribuit la descoperirea sa cu studiile sale despre scheelit . [2]
În 1841 , un chimist pe nume Robert Oxland a formulat prima procedură pentru fabricarea trioxidului de tungsten și a tungstatului de sodiu . [3] Prin urmare, este considerat tatăl chimiei sistemice a tungstenului.
Pregătirea
Trioxidul de tungsten poate fi preparat în diferite moduri. CaWO 4 , sau scheelita , poate reacționa cu HCI pentru a produce acid tungstic , care, la temperaturi ridicate, se descompune în WO 3 și apă . [2]
Un alt proces comun pentru sintetizarea WO 3 este calcinarea paratungstatului de amoniu (APT) în condiții de oxidare: [3]
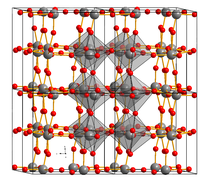
Structura
Structura cristalină a trioxidului de tungsten depinde de temperatură. La temperaturi peste 740 ° C are o structură tetragonală , de la 330 la 740 ° C este ortorombică , în timp ce de la 17 la 300 ° C este monoclinică . Presupune o structură triclinică de la 17 la -50 ° C. Este evident că cea mai comună structură a trioxidului de tungsten este cea monoclinică cu grup spațial : P2 1 / n. [3]
Proprietăți chimice
stabilitate și reactivitate
După cum sa menționat mai sus, trioxidul de tungsten poate fi sintetizat prin calcinarea APT. În funcție de condițiile de reacție, cum ar fi temperatura, proprietățile chimice ale WO 3 variază. De exemplu, la temperaturi scăzute trioxidul de tungsten este foarte reactiv și se descompune ușor în H 2 O. [3] La temperaturi mai ridicate, nu se descompune în apă. Dacă calcinarea se efectuează într-un mediu reducător, mai degrabă decât oxidant, se obține un compus complet diferit numit oxid de tungsten albastru (WO 3-x ). [4] Acest compus este o colecție de molecule diferite, inclusiv trioxid de tungsten, amoniac și WO 2 .
Reacții periculoase
Reacții cu peroxizi și alți formatori radicali. Descompunerea peroxidului de hidrogen. Nu se cunosc produși de descompunere periculoși ai trioxidului de tungsten.
Utilizări
Trioxidul de tungsten este utilizat în mai multe scopuri în viața de zi cu zi. Este frecvent utilizat în industrie pentru a crea tungstat pentru fosfori cu ecran de raze X și, de asemenea, pentru materiale ignifuge . [5] Datorită culorii sale galbene, este adesea folosit ca pigment în vopsele și ceramică [2] .
Recent, trioxidul de tungsten este utilizat în producția de sticlă electrocromică sau „ sticlă inteligentă ”. Acești ochelari sunt activi electric și își pot varia transmisia luminii în funcție de tensiunea aplicată acestora [6] . Acest lucru permite utilizatorului, de exemplu, să întunecă ferestrele și să schimbe cantitatea de lumină sau căldură transmisă. O altă nouă utilizare a tungstenului este în DIME ( Dense Inert Metal Explosive ) [7] [8] . O altă posibilă aplicație, bazată pe natura sa de semiconductor , este fotodegradarea poluanților, spațiul de bandă îngust făcându-l mai sensibil la lumina vizibilă decât dioxidul de titan .
Notă
- ^ Sigma Aldrich; rev. din 05.05.2013
- ^ a b c d Pradyot Patnaik, Manual de compuși chimici anorganici , McGraw-Hill, 2003, ISBN = 0070494398. Adus la 6 iunie 2009 .
- ^ a b c d Lassner, Erik și Wolf-Dieter Schubert, Tungsten: Properties, Chemistry, Technology of the Element, Alloys, and Chemical Compounds , New York, Kluwer Academic, 1999, ISBN 0-306-45053-4 .
- ^ "Tungsten Oxides & Acids" International Tungsten Industry Association 2003
- ^ "Trioxid de tungsten". Indicele Merck Vol. 14, 2006.
- ^ WJ Lee, YK, Jyh-Jier, WT, SF, Daoyang și Fang C., Efectele porozității suprafeței asupra performanței electrocromice a filmelor cu trioxid de tungsten (WO3) , în Journal of Electronic Materials , vol. 29, 2000, p. 183, DOI : 10.1007 / s11664-000-0139-8 .
- ^ Dense Inert Metal Explosive (DIME) Arhivat 28 august 2008 la Internet Archive .
- ^ SUA merită vina pentru sacrificarea Gaza. Arhivat 13 februarie 2009 la Internet Archive ., Linda S. Heard, 12 ianuarie 2009
Bibliografie
- ECDIN (Rețeaua de date și informații chimice de mediu)
- IUCLID (Baza de date internațională cu informații chimice uniforme)
- NIOSH - Registrul efectelor toxice ale substanțelor chimice
- Roth - Țesături Wassergefährdende
- Verschueren - Manual de date de mediu privind substanțele chimice organice
- ChemDAT - Fișe tehnice de siguranță de la E.Merck pe CD-ROM
- Merian - Metale și compușii lor din mediu
linkuri externe
- International Tungsten Industry Association , la itia.org.uk.
- Pregătirea filmelor electrocromice cu trioxid de tungsten , pe rsc.org .
- Sigma Aldrich (furnizor) , pe sigmaaldrich.com .



![{\ displaystyle {\ ce {(NH4) 10 [H2W12O42] * 4H2O -> 12 WO3 + 10 NH3 + 11H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd86f6d7bd7cc341f656880cb6c4062aa6df5402)
