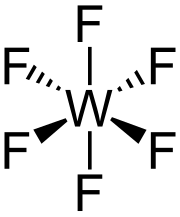
Hexafluorură de tungsten
| Hexafluorură de tungsten | |
|---|---|
| Numele IUPAC | |
| Hexafluorură de tungsten Fluorură de tungsten (VI) | |
| Caracteristici generale | |
| Formula moleculară sau brută | WF 6 |
| Masa moleculară ( u ) | 297,83 |
| Aspect | gaz incolor |
| numar CAS | |
| Numărul EINECS | 232-029-1 |
| PubChem | 522684 |
| ZÂMBETE | F[W](F)(F)(F)(F)F |
| Proprietăți fizico-chimice | |
| Densitate (kg m −3 , în cs ) | 13.2 |
| Solubilitate în apă | reacționează |
| Temperatură de topire | 2,3 ° C (275,45 K) |
| Temperatura de fierbere | 17,1 ° C (290,25 K) |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
| | |
| Expresii R. | 23/24/25, 34 |
| Fraze S. | 26, 36/37/39, 45 |
Hexafluorura de tungsten este compusul chimic dintre tungsten și fluor cu formula WF 6 . În condiții normale, este un gaz incolor coroziv, cu o densitate de aproximativ 13 g / L [1] [2] (de aproximativ 11 ori mai greu decât aerul) și, prin urmare, este unul dintre cele mai grele gaze în condiții normale. [3] WF 6 este disponibil comercial și este utilizat în principal în producția de semiconductori , circuite integrate care utilizează metoda de depunere chimică a vaporilor : moleculele WF 6 se descompun și lasă un reziduu de tungsten metalic. Acest strat este utilizat pentru a crea conexiuni cu rezistență redusă. [4]
Proprietăți fizice și structură moleculară
WF 6 este un compus molecular. La presiunea atmosferică și peste 17 ° C este un gaz diamagnetic incolor. [5] Molecula WF 6 are o structură octaedrică cu simetrie O h . Distanțele W - F sunt 183.2 pm . [6] Între 2,3 și 17 ° C se condensează într-un lichid galben deschis, care are o densitate de 3,44 g / cm 3 la 15 ° C. La 2,3 ° C se solidifică pentru a forma un solid alb cu o structură cristalină cubică , cu o constantă de rețea de 628 µm și o densitate calculată de 3,99 g / cm 3 . La -9 ° C structura se transformă în ortorombică cu constante de rețea a = 960,3 pm, b = 871,3 pm și c = 504,4 pm și densitate de 4,56 g / cm 3 . În acest stadiu, distanța W - F este de 181 pm, iar cel mai apropiat contact intermolecular mediu este de 312 pm. Valorile densității WF 6 în stare lichidă și solidă sunt destul de modeste, în timp ce în stare gazoasă WF 6 este unul dintre cele mai grele gaze cunoscute, cu o densitate mai mare decât radonul , care este cel mai greu element gazos (9,73 g / L). [7]
Sinteză
De obicei, WF 6 este produs prin reacția exotermă dintre fluor gazos și pulbere de tungsten la temperaturi cuprinse între 350 și 400 ° C: [8]
- W + 3F 2 → WF 6
Produsul gazos este condensat și separat prin distilare de WOF 4 , o impuritate obișnuită. Fluorul gazos rezultat din reacția anterioară poate fi înlocuit cu alți fluorurare agenți , cum ar fi CLF , CLF 3 sau BRF 3 . Alternativ, trioxid de wolfram (WO 3) poate fi reacționat cu HF , BRF 3 sau SF 4 . WF 6 poate fi obținut și prin conversia hexaclorurii de tungsten WCl 6 : [3]
- WCI 6 + 6HF → WF 6 + 6HCl
- WCl 6 + 2AsF 3 → WF 6 + 2AsCl 3
- WCl 6 + 3SbF 5 → WF 6 + 3SbF 3 Cl 2
Reactivitate
În contact cu apa și umiditatea, WF 6 reacționează formând fluorură de hidrogen (HF) și oxifluoruri de tungsten și, în cele din urmă, trioxid de tungsten : [3]
- WF 6 + 3H 2 O → WO 3 + 6HF
Spre deosebire de alte fluoruri metalice, WF 6 nu este nici un agent de fluorurare util, nici un oxidant puternic. [9]
Aplicații
Principalele aplicații ale WF 6 sunt în industria semiconductoarelor, unde este utilizat pe scară largă pentru depunerea tungstenului metalic folosind metoda depunerii chimice a vaporilor (CVD). Dezvoltarea industriei în anii 1980 și 1990 a dus la o creștere mondială a consumului de WF 6 , care este de aproximativ 200 de tone pe an. Tungstenul metalic este interesant pentru stabilitatea sa chimică și termică, precum și pentru rezistivitatea electrică scăzută (5,6 µΩ · cm) și electromigrarea redusă. WF 6 este, de asemenea, mai convenabil decât compuși similari, cum ar fi WCl 6 și WBr 6, deoarece are o presiune de vapori mai mare, care garantează o rată de depunere mai mare. Din 1967, au fost dezvoltate două metode de depunere, descompunerea termică și reducerea hidrogenului. [10] În funcție de aplicație, este necesar un gaz WF 6 de înaltă puritate, între 99,98% și 99,9995%. [3]
Moleculele WF 6 trebuie să fie clivate în procesul CVD. Descompunerea este în general facilitată prin amestecarea WF 6 cu hidrogen, silan , german , diboran , fosfină și alte gaze similare care conțin hidrogen.
Siliciu
WF 6 reacționează în contact cu un substrat de siliciu. [3] Descompunerea WF 6 pe siliciu depinde de temperatură:
- 2WF 6 + 3Si → 2W + 3SiF 4 sub 400 ° C e
- WF 6 + 3Si 2 → W + 3SiF 2 peste 400 ° C.
Această dependență este crucială, deoarece de două ori mai mult siliciu este consumat la temperaturi mai ridicate. Depunerea are loc selectiv numai pe siliciu pur, nu pe oxid de siliciu sau nitrură și, prin urmare, reacția este extrem de sensibilă la contaminarea sau pretratarea substratului. Reacția de descompunere este rapidă, dar se oprește când grosimea stratului de tungsten ajunge la 10-15 micrometri , deoarece acest strat de tungsten nu permite moleculelor WF 6 să ajungă la substratul de siliciu care este singurul catalizator pentru descompunerea WF 6 . [3]
Dacă depunerea nu se efectuează într-o atmosferă inertă, ci în prezența oxigenului (în aer), se depune un strat de oxid de tungsten. [11]
Hidrogen
Cu hidrogen, procesul de depunere necesită temperaturi între 300 și 800 ° C și conduce la formarea vaporilor de fluorură de hidrogen :
- WF 6 + 3H 2 → W + 6HF
Cristalinitatea straturilor de tungsten produse poate fi ajustată prin variația raportului WF 6 / H 2 și a temperaturii substratului: raporturile și temperaturile scăzute produc cristalite de tungsten cu orientare (100) în timp ce valorile mai mari favorizează orientarea (111). Formarea HF este un dezavantaj, deoarece vaporii de HF sunt foarte agresivi și afectează majoritatea materialelor. Mai mult, tungstenul depus are o aderență slabă la dioxidul de siliciu, care este principalul material pasivizat utilizat în electronica semiconductorilor. Din acest motiv, SiO 2 trebuie acoperite cu un strat tampon suplimentar înainte de depunerea tungsten. Pe de altă parte, gravarea chimică cu HF poate fi utilă pentru îndepărtarea straturilor de impurități. [3]
Silane și germană
Viteza mare, aderența bună și uniformitatea acoperirii sunt caracteristicile depunerii folosind WF 6 / SiH 4 . Dezavantajele sunt pericolul de explozie și sensibilitatea mare a ratei de depunere și a morfologiei la parametrii de procesare, cum ar fi raportul amestecului, temperatura substratului etc. Din acest motiv, silanul este utilizat în general pentru a crea un strat subțire de nucleație de tungsten. Trecem apoi la hidrogen, care încetinește depunerea și curăță stratul. [3]
Depunerea cu amestecuri WF 6 / GeH 4 este similară cu cele cu WF 6 / SiH 4 , dar stratul de tungsten este mai contaminat cu germaniu (decât cu siliciu). Germaniul poate atinge concentrații de 10–15%, iar rezistența tungstenului crește la valori de 5–200 µΩ · cm. [3]
Alte utilizări
WF 6 poate fi utilizat pentru a produce carbură de tungsten .
Ca gaz greu, WF 6 poate fi utilizat pentru moderarea reacțiilor în stare gazoasă. De exemplu, încetinește cinetica flăcării Ar / O 2 / H 2 și reduce temperatura acesteia. [12]
Siguranță
WF 6 este un compus foarte coroziv și atacă toate țesăturile. Expunerea la om afectează mai întâi ochii și căile respiratorii provocând iritații, pierderea vederii, tuse, salivație excesivă și spută pulmonară. În contact cu fluidele corpului, gazul formează acid fluorhidric care arde pielea și membranele mucoase ale sistemului respirator. Expunerea prelungită produce edem pulmonar și poate fi fatală. Nu este considerat cancerigen. [2]
Curiozitate
În cartea sa Uncle Tungsten , Oliver Sacks descrie modul în care unchiul său, un mare iubitor de tungsten și chimia acestuia, i-a spus despre hexafluorură de tungsten și densitatea sa mare. Cu ocazia împlinirii a 65 de ani, Sacks s-a gândit să umple un balon cu WF 6 , dar s-a abținut să facă acest lucru știind că în contact cu umiditatea atmosferică ar reacționa pentru a forma acid fluorhidric. [13] (În plus, WF 6 ar reacționa cu majoritatea materialelor organice, inclusiv cauciucul. Numai teflonul ar fi fost potrivit.)
Notă
- ^ Qualiflow, diagramă de gaze ( PDF ), la qualiflow.com . Adus la 16 mai 2011 .
- ^ a b Linde Gas, WF 6 MSDS ( PDF ), la orcbs.msu.edu . Adus la 3 iulie 2017 (arhivat din original la 12 februarie 2010) .
- ^ a b c d e f g h i E. Lassner, W.-D. Schubert, http://books.google.com/?id=foLRISkt9gcC&pg=PA168#v=onepage&q= , în Tungsten: proprietăți, chimie, tehnologia elementului, aliaje și compuși chimici , Springer, 1999, pp. 111, 168, ISBN 0-306-45053-4 .
- ^ TimeDomain CVD Inc., Depunere chimică de vapori de tungsten și silicură de tungsten , pe timedomaincvd.com . Adus la 17 mai 2011 .
- ^ TW Pernrice, compuși de tungsten , în Kirk-Othmer Encyclopedia of Chemical Technology , ediția a IV-a, John Wiley & Sons, 1998.
- ^ DR Lyde (ed.), CRC Handbook of Chemistry and Physics , 86th ed., Boca Raton (FL), CRC Press, 2005, pp. 4-93, ISBN 0-8493-0486-5 .
- ^ JH Levy, JC Taylor, PW Wilson, Structurile fluorurilor XIII: Forma ortorombică a hexafluorurii de tungsten la 193 K prin difracție de neutroni , în J. Solid State Chem. , vol. 15, nr. 4, 1975, pp. 360-365, DOI : 10.1016 / 0022-4596 (75) 90292-3 . Adus la 17 mai 2011 .
- ^ HF Priest, fluoruri metalice anhidre , în Inorg. Sintetizator. , vol. 3, 1950, pp. 171–183, DOI : 10.1002 / 9780470132340.ch47 . Adus la 17 mai 2011 .
- ^ NN Greenwood, A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ^ J. Aigueperse, P. Mollard, D. Devilliers, M. Chemla, R. Faron, R. Romano, JP Cuer, Fluorine Compounds, Inorganic , în Ullmann's Encyclopedia of Industrial Chemistry , Weinheim, Wiley-VCH, 2005.
- ^ RU Kirss, L. Meda, <155 :: AID-AOC688> 3.0.CO; 2-Z Depunerea chimică prin vapori a oxidului de tungsten , în Appl. Organomet. Chem. , vol. 12, nr. 3, 1998, pp. 155-160, DOI : 10.1002 / (SICI) 1099-0739 (199803) 12: 3 <155 :: AID-AOC688> 3.0.CO; 2-Z . Adus la 17 mai 2011 .
- ^ P. Ifeacho, nanoparticule de oxid de metal semiconductor dintr-o flacără H 2 / O 2 / Ar premixată la presiune scăzută: sinteză și caracterizare (Disertație, Universitatea din Duisburg-Essen) , Göttingen, Cuvillier, 2008, ISBN 3-86727- 816-4 .
- ^ O. Sacks, Zio Tungsteno , Milano, Adelphi, 2002, ISBN 978-88-459-2113-1 .