Fluorură de tionil
| Fluorură de tionil | |
|---|---|
| Numele IUPAC | |
| difluor (os) -λ 4 -sulfan | |
| Denumiri alternative | |
| difluorură de tionil | |
| Caracteristici generale | |
| Formula moleculară sau brută | F 2 OS |
| Aspect | gaz incolor |
| numar CAS | |
| Numărul EINECS | 231-997-2 |
| PubChem | 24548 |
| ZÂMBETE | O=S(F)F |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1.780 (-100 ° C) [1] |
| Solubilitate în apă | reacționează |
| Temperatură de topire | −129,5 ° C (144 K) [2] |
| Temperatura de fierbere | −43,8 ° C (229 K) [2] |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
  | |
| Fraze H | 300 - 310 - 330 - 314 [3] |
Sau fluorură de tionil tionil difluorură este compus anorganic cu formula SOF 2. În condiții normale, este un gaz incolor, cu miros sufocant. [1] În acest compus, sulful are o stare de oxidare de +4.
Structura
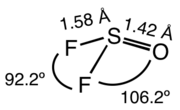
SOF 2 este un compus molecular, gazos la temperatura camerei. Forma moleculei este cea a unei piramide distorsionate, cu simetrie C s . [4] Distanțele SO și respectiv SF sunt 142.0 pm e 158,3 pm ; unghiurile OSF și FSF sunt 106,2 ° și respectiv 92,8 °. Halogenurile corespunzătoare SOCI2 și SOBr2 au structuri similare, dar sunt lichide la temperatura camerei. Halogenurile mixte, de tip SOClF și SOBrF, sunt, de asemenea, cunoscute. [2]
Sinteză
Fluorura de tionil a fost obținută pentru prima dată în 1896 de Maurice Meslans (1862-1938), elev al lui Henri Moissan , prin tratarea clorurii de tionil cu fluorură de zinc . [5] Ulterior au fost utilizate alte surse de ioni fluor, cum ar fi fluorură de hidrogen [1] sau trifluorură de antimoniu : [2] [6]
Alternativ, dioxidul de sulf poate fi fluorurat cu pentafluorură de fosfor : [2]
Reactivitate
SOF 2 este un gaz stabil termic până la căldură roșie. Sub 125 ° C nu atacă sticla sau metalele fier, nichel, cobalt, mercur, magneziu, aluminiu și zinc. [1] În contact cu apa se hidrolizează formând dioxid de sulf și acid fluorhidric: [2]
Reacționează cu fluor pentru a forma tetrafluorură de tionil : [2]
Din punct de vedere chimic, SOF 2 se comportă ca o bază Lewis slabă, prin dubletul nepartajat de oxigen și, de asemenea, ca un acid Lewis slab, care se leagă prin sulf; în acest sens reacționează cu ionii F - formând anionul [O = SF 3 ] - . [2]
Notă
Bibliografie
- ( EN ) HS Booth și FC Mericola, Fluorinarea clorurii de tionil , în J. Am. Chem. Soc. , Vol. 62, nr. 3, 1940, pp. 640-642, DOI : 10.1021 / ja01860a058 .
- ( EN ) G. Brauer, Manual de preparare chimie anorganică , vol. 1, ediția a doua, New York, Academic Press, 1963, ISBN 0323161278 .
- GESTIS, fluorură de tionil , pe gestis-en.itrust.de . Adus la 17 decembrie 2019 . Pagina fluorură de tionil din baza de date GESTIS.
- ( EN ) NN Greenwood și A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ( DE ) AF Holleman și N. Wiberg, Lehrbuch der Anorganischen Chemie , Berlin, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1 .
- ( EN ) WC Smith și EL Muetterties, fluorură de tionil , în Inorg. Sintetizator. , vol. 6, 1960, pp. 162-163, DOI : 10.1002 / 9780470132371.ch50 .
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe fluorură de tionil
Wikimedia Commons conține imagini sau alte fișiere pe fluorură de tionil