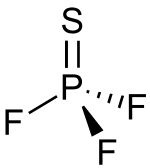
Trifluorură de tiofosforil
| Trifluorură de tiofosforil | |
|---|---|
| Numele IUPAC | |
| Trifluor (sulfoniliden) -λ 5 -fosfan | |
| Caracteristici generale | |
| Formula moleculară sau brută | PSF 3 |
| Aspect | gaz incolor |
| numar CAS | |
| ZÂMBETE | FP(F)(F)=S |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1,56 |
| Solubilitate în apă | reacționează |
| Temperatură de topire | −148,8 ° C (124 K) [1] |
| Temperatura de fierbere | −52,2 ° C (221 K) [1] |
| Informații de siguranță | |
Tiofosforil trifluorura este compus anorganic cu formula PSF 3. În acest fluor , fosforul este în mod formal în starea de oxidare +5. În condiții normale, este un gaz incolor care se hidrolizează la contactul cu apa și se aprinde spontan în aer. [1] [2]
Sinteză
Trifluorura de tiofosforil a fost sintetizată pentru prima dată de Thorpe și Rodger în 1888 prin încălzirea pentasulfurii de fosfor și a fluorului de plumb în absența aerului și a umezelii: [3] [4]
Ei au observat că PSF 3 a fost , de asemenea , obținut prin încălzirea P 2 S 5 și BIF 3 , sau de la PBF 2, sulf și fosfor, sau , de asemenea , de la asf 3 și PSCl 3 .
Au fost descrise ulterior alte metode de producere a compusului. Fluorura de sodiu poate fi adăugat la PSCl 3 în acetonitril soluție. [5] În caz contrar, trifluorura de fosfor poate reacționa cu hidrogenul sulfurat , cu condiția ca la 200 ° C și 4000 atm: [6]
PF 3 și sulful pot reacționa, de asemenea, sub presiune. [7]
Proprietate
Trifluorura de tiofosforil este un compus molecular polar . Forma moleculei este de tip tetraedric, cu simetrie C 3v . [1] Rezultatul distanței PS 187 ± 3 pm , acel PF 153 ± 2 pm și unghiul FPF este de 100,3 ° ± 2 ° . [8]
Reactivitate
Chimia trifluorurii de tiofosforil a fost deja caracterizată de Thorpe și Rodger în 1889. [4] În condiții normale, compusul este un gaz foarte reactiv; sub presiune se condensează pentru a forma un lichid incolor. În prezența umidității, aerul se aprinde spontan cu o flacără care variază de culoare de la albastru la gri-verde în funcție de condiții, producând în același timp fumuri albe. În cazul oxigenului uscat, arderea poate să nu fie spontană și flacăra să fie galbenă. Produsele finale par a fi PF 5 , P 2 O 5 și SO 2 . O particularitate a acestor flăcări este temperatura lor scăzută. Thorpe și Rodger au remarcat: [4]
„Este probabil una dintre cele mai reci flăcări cunoscute. Mâinile noastre au fost deseori înconjurate de ea fără a provoca senzații de căldură prea enervante. " |
Se descompune la încălzire formând sulf, fosfor și fluoruri de sulf. Dacă este încălzit într-un tub de sticlă, compusul se descompune atacând sticla, cu formarea de SiF 4 , în funcție de reacție:
În apă se hidrolizează rapid, oferind soluții acide, conform reacției:
În soluție de bază se dizolvă mai rapid decât în apă, dând naștere reacției
Reacția cu amoniac gazos duce la formarea fumurilor albe; datele analitice sunt în concordanță cu reacția
Atomii de fluor pot fi înlocuiți pentru a da compuși derivați, cum ar fi PSF 2 Cl , PSFCl 2 , PSF 2 Br , PSFBr 2 , PSFClBr, PS (NCO) 3 și PS (NCS) 3 . De asemenea, sunt cunoscuți compuși condensați, cum ar fi P 2 S 4 F 4 . [1] [2]
Notă
Bibliografie
- ( EN ) G. Bettermann, W. Krause, G. Riess și T. Hofmann, Compuși de fosfor, anorganici , în Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, 2002, DOI : 10.1002 / 14356007.a19_527 .
- ( EN ) NN Greenwood și A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ( EN ) AP Hagen și EA Elphingstone, interacțiune de înaltă presiune a trifluorurii de fosfor cu oxigen, sulf, seleniu și telur , în Inorg. Chem. , vol. 12, nr. 2, 1973, pp. 478-480, DOI : 10.1021 / ic50120a050 .
- ( EN ) AP Hagen și BW Callaway, Reacții de înaltă presiune ale moleculelor covalente mici. 10. Reacția trifluorurii de fosfor cu hidrogen sulfurat și dioxid de sulf , în Inorg. Chem. , vol. 17, n. 3, 1978, pp. 554-555, DOI : 10.1021 / ic50181a007 .
- ( EN ) DK Padma, SK Vijayalakshmi și AR Vasudevamurthy, Investigații privind reacțiile de preparare, oxidare și reducere a fluorurii de tiofosforil , în Journal of Fluorine Chemistry , vol. 8, nr. 6, 1976, pp. 461-465, DOI : 10.1016 / S0022-1139 (00) 81660-7 .
- ( EN ) TE Thorpe și JW Rodger, LX. - Fluorură de tiofosforil , în J. Chem. Soc., Trans. , vol. 53, 1888, pp. 766-767, DOI : 10.1039 / CT8885300766 .
- ( EN ) TE Thorpe și JW Rodger, XXXIV - Despre fluorura de tiofosforil , în J. Chem. Soc., Trans. , vol. 55, 1889, pp. 306-323, DOI : 10.1039 / CT8895500306 .
- (RO) Q. Williams, J. Sheridan și W. Gordy, microunde Spectra și structurile moleculare ale POF 3, PSF 3, POCI3 și PSCl 3 , în J. Chem. Fizic. , vol. 20, nr. 1, 1952, pp. 164, DOI : 10.1063 / 1.1700162 .