Tetrafluorură de ruteniu
| Tetrafluorură de ruteniu | |
|---|---|
| Numele IUPAC | |
| tetrafluorură de ruteniu | |
| Denumiri alternative | |
| fluorura de ruteniu (IV) | |
| Caracteristici generale | |
| Formula moleculară sau brută | F 4 Ru |
| Greutatea formulei ( u ) | 177.06 |
| Aspect | roz solid [1] |
| numar CAS | |
| PubChem | 167109 |
| Proprietăți fizico-chimice | |
| Solubilitate în apă | reacție violentă |
| Informații de siguranță | |
Tetrafluorura ruteniu este compus anorganic cu formula Ruf 4. În acest fluor , ruteniul se află în starea de oxidare +4. În condiții normale, este un solid de culoare roz. [1] [2] Este un compus extrem de reactiv și reacționează violent în prezența apei.
Sinteză
Compusul a fost preparat pentru prima dată în 1963 de Holloway și Peacock, care au obținut un solid galben prin reducerea pentafluorurii de ruteniu cu iod folosind pentafluorură de iod ca solvent. [3]
- 10 RuF 5 + I 2 → 10 + 2 IF 5
Studiile ulterioare au indicat că RuF 4 produs pe această cale este impur. Compusul pur, de culoare roz, a fost izolat pentru prima dată în 1992 prin reacția K 2 RuF 6 cu AsF 5 la 20 ° C în acid fluorhidric anhidru, excluzând strict apa și oxigenul. [2] Această sinteză exploatează capacitățile de acceptare foarte puternice ale ionilor de fluor ai acidului Lewis AsF 5 .
- K 2 RuF 6 + 2 AsF 5 → RuF 4 + 2 KAsF 6
Structura
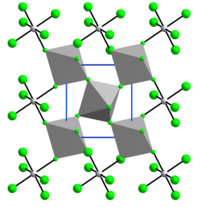
RuF 4 în stare solidă este polimeric, cu o structură tridimensională cu straturi ondulate care conțin octaedri RuF 6 unite prin atomi de fluor împărțiți (vezi figura). [1] Structura cristalină este similară cu cea a VF 4 și este monoclinică , grupul spațial P2 1 / n, cu constante de rețea a = 560,7 pm , b = 494,6 pm și c = 514,3 pm , β = 121,27 °, două unități de formulă pe unitate de celulă . [2]
Proprietăți și reactivitate
RuF 4 este un compus extrem de reactiv care se întunecă imediat în contact cu umezeala și reacționează violent cu apa, depunând dioxid de ruteniu . Poate fi depozitat în recipiente de sticlă, care sunt totuși atacate dacă proba este încălzită la peste 280 ° C. [3]
Notă
Bibliografie
- ( EN ) WJ Casteel Jr., AP Wilkinson, H. Borrmann, RE Serfass și N. Bartlett, Prepararea și structura tetrafluorurii de ruteniu și o comparație structurală cu trifluorura de ruteniu și pentafluorura de ruteniu , în Inorg. Chem. , vol. 31, n. 14, 1992, pp. 3124-3131, DOI : 10.1021 / ic00040a024 .
- (EN) FA Cotton, G. Wilkinson, CA Murillo și M. Bochmann,Advanced Inorganic Chemistry , ediția a VI-a, Wiley-Interscience, 1999, ISBN 978-0471199571 .
- ( EN ) JH Holloway și RD Peacock, tetrafluorură de ruteniu , în J. Chem. Soc. , 1963, pp. 3892-3893, DOI : 10.1039 / JR9630003879 .