Oxid de potasiu
| Oxid de potasiu | |
|---|---|
| Numele IUPAC | |
| oxid de dipotasiu | |
| Caracteristici generale | |
| Formula moleculară sau brută | K 2 O |
| Greutatea formulei ( u ) | 94.196 |
| Aspect | gri solid |
| numar CAS | |
| Numărul EINECS | 235-227-6 |
| PubChem | 9989219 |
| ZÂMBETE | [O-2].[K+].[K+] |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 2.35 |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
| | |
| Expresii R. | 20/21 / 22-34-36 / 37/38 |
| Fraze S. | nd |
Oxid de potasiu (K 2 O) este un compus ionic de potasiu și oxigen . Acest solid galben pal, cel mai simplu dintre oxizii de potasiu, este un compus rar și foarte reactiv. Unele materiale comerciale, cum ar fi îngrășămintele și cimenturile, sunt dozate presupunând compoziția procentuală care ar fi echivalentă cu amestecul de compuși chimici K 2 O.
Producție
Oxidul de potasiu este produs de reacția oxigenului și potasiului; această reacție dă peroxid de potasiu , K 2 O 2. Tratamentul peroxidului cu potasiu produce oxidul: [1]
Alternativ , și mai convenabil, K 2 O este sintetizat prin încălzirea nitrat de potasiu cu potasiu metalic:
O altă posibilitate este încălzirea peroxidului de potasiu la 500 ° C, care se descompune la acea temperatură, dând oxigen pur și oxid de potasiu:
Hidroxidul de potasiu nu poate fi deshidratat suplimentar în oxid, dar poate reacționa cu potasiu topit pentru a-l produce, eliberând hidrogen ca subprodus:
Proprietăți și reacții
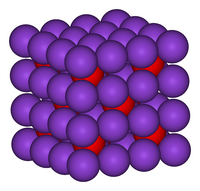
K 2 O cristalizează în structura antifluorită. Din acest motiv, pozițiile anionilor și cationilor sunt inversate față de pozițiile lor în CaF 2 , cu ioni de potasiu coordonați cu 4 ioni de oxid și ioni de oxid coordonați cu 8 ioni de potasiu [2] . K 2 O este un oxid bazic și reacționează violent cu apa pentru a produce hidroxid de potasiu caustic. Deoarece este și deliquescent , poate reacționa absorbind apa din atmosferă.
Notă
- ^ Holleman, AF; Wiberg, E. „Chimie anorganică” Academic Press: San Diego, 2001. ISBN 0-12-352651-5 .
- ^ E. Zintl , A. Harder și Dauth B., Gitterstruktur der oxyde , sulfide , selenide und telluride des lithiums , natriums und kaliums , în Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie , vol. 40, 1934, pp. 588–93.
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre oxidul de potasiu
Wikimedia Commons conține imagini sau alte fișiere despre oxidul de potasiu