Clorură de vanadiu (III)
| Clorură de vanadiu (III) | |
|---|---|
| Numele IUPAC | |
| Clorură de vanadiu (III), triclorură de vanadiu | |
| Caracteristici generale | |
| Formula moleculară sau brută | VCl 3 |
| Masa moleculară ( u ) | 157,30 |
| Aspect | violet închis solid |
| numar CAS | |
| Numărul EINECS | 231-744-6 |
| PubChem | 62647 |
| ZÂMBETE | Cl[V](Cl)Cl |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 3 [1] |
| Solubilitate în apă | descompunere |
| Temperatură de topire | > 300 ° C (dec) [1] |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | -581 [2] |
| Proprietăți toxicologice | |
| LD 50 (mg / kg) | 350 (șobolan, oral) [1] |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
  | |
| Pericol | |
| Fraze H | 302 - 314 |
| Sfaturi P | 280 - 305 + 351 + 338 - 310 |
Vanadiu (III) sau clorură de vanadiu triclorură este compus anorganic cu formula VCI3. În condiții normale, este un solid violet închis, foarte higroscopic și sensibil la oxidare . [3] VCI3 este disponibil în comerț. Este utilizat industrial ca catalizator pentru producerea de cauciucuri și polietilenă și ca precursor pentru sinteza altor compuși de vanadiu . [4]
Istorie
Compusul VCl 3 a fost obținut pentru prima dată în 1869 de Henry Enfield Roscoe , prin descompunerea termică a VCl 4 . [5] [6]
Structura moleculară și configurația electronică
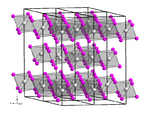
VCI3 este un solid polimeric. În stare solidă are o structură cristalină hexagonală similară cu cea a iodurii de bismut , grupul spațial R 3 cu constante de rețea a = 601 pm și c = 1734 pm, șase unități de formulă pe unitate de celulă . [7] Atomii de vanadiu sunt hexacoordinați. Structura poate fi descrisă ca un ambalaj hexagonal compact de anioni clorură, în timp ce cationii V 3+ sunt localizați în fiecare alt strat, ocupând două treimi din interstițiile octaedrice. [8] [9] Ioniul V 3+ are o configurație electronică d 2 , iar cei doi electroni nepereche fac compusul paramagnetic . [3]
Sinteză
VCI3 pot fi preparate în diverse moduri. [10] [11]
O posibilitate este încălzirea VCl 4 la 160-170 ° C folosind un flux de gaz inert pentru a elimina clorul :
- 2VCl 4 → 2VCl 3 + Cl 2
Poate fi obținut și prin sinteză directă prin reacția clorului lichid într-un tub sigilat cu vanadiu metalic:
- 2V + 3Cl 2 → 2VCl 3
Alte posibilități sunt:
Reactivitate
VCl 3 este un compus foarte higroscopic și foarte sensibil la oxidare. De asemenea, este foarte sensibil la prezența oxigenului, care determină formarea de oxicloruri precum VOCl, VOCl 2 și VOCl 3 . [9] [12]
Dizolvat în apă formează ionul hexaqua [V (H 2 O) 6 ] 3+ . [3] Din aceste soluții este posibil să se obțină sarea hidratată VCl 3 • 6H 2 O care are de fapt o structură trans - [V (H 2 O) 4 Cl 2 ] Cl • 2H 2 O. [2] [13]
În soluție, în prezența altor liganzi, se formează complexe paramagnetice , având în vedere configurația electronică d 2 a ionului V 3+ . În general, se formează complexe octaedrice precum [VL 6 ] 3+ , [VCl 2 L 4 ] + , [VCl 3 L 3 ] sau [VCl 6 ] 3– , dar sunt posibile și alte geometrii, cum ar fi [VCl 4 ] - (tetraedric) și [V (CN) 7 ] 4– (bipiramidă pentagonală). [2]
Informații privind toxicitatea / siguranța
VCl 3 este disponibil comercial. Compusul provoacă arsuri severe ale pielii și leziuni oculare severe. Este dăunător dacă este înghițit. Nu există dovezi ale efectelor cancerigene. Nu sunt disponibile date privind efectele asupra mediului. [1]
Notă
Bibliografie
- ( EN ) G. Bauer, V. Güther, H. Hess, A. Otto, O. Roidl, H. Roller și S. Sattelberger, compuși de vanadiu și vanadiu , în Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, 2002, DOI : 10.1002 / 14356007.a27_367 .
- ( EN ) G. Brauer, Manual de preparare chimie anorganică , vol. 2, ediția a doua, New York, Academic Press, 1965.
- WF Donovan și PW Smith, structuri cristaline și moleculare ale complexelor aquahalogenovanadiu (III). Partea I. Structura cristalină cu raze X a dihidratului de bromură trans-tetrakisaquadibromo-vanadiu (III) și a compusului clor izomorf , în J. Chem. Soc., Dalton Trans. , 1975, pp. 894-896, DOI : 10.1039 / DT9750000894 . Adus la 18 martie 2014 .
- P. Ehrlich și H.-J. Seifert, Über Vanadinchloride , în Z. anorg. Anexă Chem. , vol. 301, n. 5-6, 1959, pp. 282-287, DOI : 10.1002 / zaac . 19593010508 . Adus la 18 martie 2014 .
- ( EN ) NN Greenwood și A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ( DE ) AF Holleman și N. Wiberg, Lehrbuch der Anorganischen Chemie , Berlin, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1 .
- W. Klemm și E. Krose, Die Kristallstrukturen von SCCL 3, TiCI3 und VCL 3 , în Z. anorg. Chem. , vol. 253, n. 3-4, 1947, pp. 218-225, DOI : 10.1002 / zaac.19472530313 . Adus la 18 martie 2014 .
- ( EN ) U. Müller, Chimie structurală anorganică , ediția a II-a, Wiley, 2006, ISBN 978-0-470-01864-4 .
- ( EN ) RL Richards, Vanadiu: chimie anorganică și de coordonare , în Enciclopedia chimiei anorganice , ediția a II-a, John Wiley & Sons, 2006, DOI : 10.1002 / 0470862106.ia253 , ISBN 978-0-470-86210-0 .
- HE Roscoe, Cercetări despre vanadiu. Partea a II-a. Despre clorurile de vanadiu și vanadiu metalic , în Chemical News , vol. 20, nr. 504, 1869, pp. 37-38. Adus la 18 martie 2014 .
- HE Roscoe, XXVI - Cercetări despre vanadiu. Partea a II-a. Pe clorurile de vanadiu și vanadiu metalic , în J. Chem. Soc. , Vol. 23, 1870, pp. 344-358, DOI : 10.1039 / JS8702300344 . Adus la 18 martie 2014 .
- Sigma-Aldrich, clorură de vanadiu (III) , pe sigmaaldrich.com . Adus la 18 martie 2014 .
- RC Young și ME Smith, clorură de vanadiu (II) ( TXT ), în Inorg. Sintetizator. , vol. 4, 1953, pp. 128-130. Adus la 18 martie 2014 .