Oxid de antimoniu (III)
| Oxid de antimoniu (III) | |
|---|---|
| Numele IUPAC | |
| Oxid de antimoniu (III), trioxid de diantimoniu | |
| Denumiri alternative | |
| Trioxid de antimoniu, sesquioxid de antimoniu, oxid de antimoniu | |
| Caracteristici generale | |
| Formula moleculară sau brută | Sb 2 O 3 |
| Masa moleculară ( u ) | 291,50 |
| Aspect | alb solid |
| numar CAS | |
| Numărul EINECS | 215-175-0 |
| PubChem | 16684270 |
| ZÂMBETE | O=[Sb]O[Sb]=O e [O-2].[O-2].[O-2].[Sb+3].[Sb+3] |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 5.2 (cub) [1] 5.8 (ortorombic) [1] |
| Solubilitate în apă | practic insolubil [2] |
| Temperatură de topire | 655 ° C (928 K) [2] |
| Temperatura de fierbere | 1 425 ° C (1 698 K) [2] |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | –720,3 (cub) [1] –708,5 (ortorombic) [1] |
| Proprietăți toxicologice | |
| LD 50 (mg / kg) | > 34 600 șobolan oral [2] |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
 | |
| Atenţie | |
| Fraze H | 351 [2] |
| Sfaturi P | 281 - 308 + 313 [2] |
Trioxid diantimoniu sau oxid de antimoniu (III) este compusul anorganic cu formula Sb 2 O 3. În condiții normale, este un solid alb practic insolubil în apă și este compusul de antimoniu de cea mai mare importanță comercială. Apare în mod natural în mineralele valentinite și sénarmontite . [3]
Sinteză
Majoritatea Sb 2 O 3 se obține prin prăjirea stibnitei (Sb 2 S 3 ). [4] [5]
- 2SB 2 S 3 + 9O 2 → 2SB 2 O 3 + 2 6SO
Temperatura și cantitatea de oxigen trebuie reglate cu atenție pentru a asigura volatilizarea eficientă a Sb 2 O 3 și, în același timp, a minimiza oxidarea la oxid de antimoniu (IV) , Sb 2 O 4 . O serie de condensatoare la ieșirea cuptorului separă Sb 2 O 3 de impuritățile prezente care sunt de obicei Sb 2 O 4 și PbO 2 (mai puțin volatile) și As 2 O 3 (mai volatile).
Alternativ, antimoniul metalic poate fi prăjit în aer; Sb 2 O 3 se sublimează și se colectează prin condensare. O altă metodă este prin hidroliza triclorurii de antimoniu în soluție bazică. [1] [5] Reacțiile sunt:
- 4Sb + 3O 2 → 2Sb 2 O 3
- 2SbCl 3 + 3OH - → Sb 2 O 3 + 6Cl - + 3H +
Reactivitate
Sb 2 O 3 este un oxid amfoteric, aproape insolubil în apă, dar solubil în acizi și baze. În acizii HX puternici concentrați se dizolvă formând săruri antimonil (SbOX) și săruri SbX 3 . [1] De exemplu, în acid clorhidric:
- Sb 2 O 3 + 2HCl → 2SbOCl + H 2 O
- SbOCl + 2HCl → SbCl 3 + H 2 O
În soluție bazică de hidroxid de sodiu se dizolvă formând NaSb (OH) 4 antimonite care pot fi deshidratate în NaSbO 2 meta-antimonite: [1]
- Sb 2 O 3 + 2NaOH + 3H 2 O → 2NaSb (OH) 4
- NASB (OH) 4 → NaSbO 2 + 2H 2 O
Sb 2 O 3 poate fi ușor redus la metal atunci când este încălzit cu cărbune , hidrogen sau monoxid de carbon . [1] Cu agenți reducători, cum ar fi hidrura de litiu aluminiu , se formează stibină , un gaz instabil și foarte toxic. [6] Sb 2 O 3 poate fi oxidat la Sb 2 O 4 prin încălzire la 700-1000 ° C , în prezența aerului; [1] tratat cu acid azotic se oxidează la Sb 2 O 5 . [5] Prin încălzire cu bitartrat de potasiu, se formează antimoniltartrat de potasiu K 2 Sb 2 (C 4 H 2 O 6 ) 2 · 3H 2 O. [1]
Structura
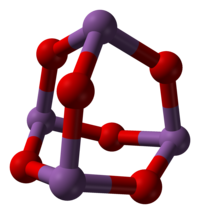
Sb 2 O 3 există în diferite modificări structurale. La temperatură ridicată în faza gazoasă este format din molecule de Sb 4 O 6 , care au o structură similară cu oxidul de fosfor analog, P 4 O 6 (vezi figura), cu distanțe Sb - O de 200 pm . [1] Aceeași structură a cuștii este observată la temperatura camerei în solidul care cristalizează în sistemul cubic , cu o distanță Sb-O de 197,7 µm și unghiuri O-Sb-O de 95,6 °. [7] Această formă există în mod natural în sénarmontita minerală. [8] Peste 606 ° C forma ortorombică devine mai stabilă, constând din perechi de lanțuri –Sb - O - Sb - O– în care atomii de antimoniu sunt legați de punți de oxigen. Această formă există în mod natural în mineralul valentinite . [8]
Utilizări
Consumul anual de Sb 2 O 3 în Statele Unite și Europa este de aproximativ 10.000 și, respectiv, 25.000 de tone. Principala aplicație este ca un ignifug în combinație cu compuși halogenați, pentru utilizare pe rășini și polimeri utilizați în echipamente electrice, textile, materiale plastice și acoperiri auto. [4] Printre alte utilizări principale, este utilizat ca opacifiant pentru vitrine ceramice , la fabricarea pigmenților , ca catalizator pentru producerea poliesterilor .
Informații privind toxicitatea / siguranța
Sb 2 O 3 este disponibil comercial. Este un cancerigen suspectat pe baza experimentelor pe animale. Este considerat nu foarte periculos pentru mediul acvatic. [2]
Notă
Bibliografie
- ( EN ) JM Bellama și AG MacDiarmid, Sinteza hidrurilor de germaniu, fosfor, arsen și antimoniu prin reacția în fază solidă a oxidului corespunzător cu hidrură de litiu aluminiu , în Inorg. Chem. , vol. 7, nr. 10, 1968, pp. 2070–2072, DOI : 10.1021 / ic50068a024 .
- GESTIS, trioxid de antimoniu , pe gestis-en.itrust.de . Adus la 20 decembrie 2015 .
- ( EN ) NN Greenwood și A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ( EN ) SC Grund, K. Hanusch, HJ Breunig și HU Wolf, Antimony and Antimony Compounds , în Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, 2002, DOI : 10.1002 / 14356007.a03_055 .
- ( DE ) AF Holleman și N. Wiberg, Lehrbuch der Anorganischen Chemie , Berlin, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1 .
- ( EN ) P. Patnaik, Manual de produse chimice anorganice , New York, McGraw-Hill, 2003, ISBN 0-07-049439-8 .
- ( EN ) C. Svensson, Rafinarea structurii cristaline a oxidului de antimoniu cubic (III), Sb 2 O 3 , în Acta Crystallographica , B31, 1975, pp. 2016–2018, DOI : 10.1107 / S0567740875006759 .
- (EN) AF Wells, Structural Inorganic Chemistry, ed. A V-a, Oxford University Press, 1984. ISBN 978-0-19-855370-0 .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre oxidul de antimoniu
Wikimedia Commons conține imagini sau alte fișiere despre oxidul de antimoniu