Dioxid de mangan
| Dioxid de mangan | |
|---|---|
| Denumiri alternative | |
| Dioxid de mangan Oxid de mangan IV | |
| Caracteristici generale | |
| Formula moleculară sau brută | MnO 2 |
| Masa moleculară ( u ) | 86,94 |
| Aspect | gri cenușiu până la negru |
| numar CAS | |
| Numărul EINECS | 215-202-6 |
| PubChem | 14801 |
| ZÂMBETE | O=[Mn]=O |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 5.026 (20 ° C) |
| Solubilitate în apă | (20 ° C) insolubil |
| Temperatură de topire | 535 ° C (808 K) (descompunere) |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | −520,9 |
| S 0 m (J K −1 mol −1 ) | 53.1 |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
  | |
| Pericol | |
| Fraze H | 302 + 332 |
| Sfaturi P | 314 [1] |
Dioxidul de mangan este oxidul de mangan (IV) . Compus chimic are formula MnO 2, dar este adesea non-stoichiometric . Este un solid de culoare gri până la negru, care se găsește în mod natural în piroluzită , principalul mineral din care se extrage manganul . Este prezent și în nodulii de mangan de pe fundul mării. Principala utilizare a MnO 2 este în baterii , cum ar fi bateriile alcaline și zinc-carbon. [2] Este, de asemenea, utilizat pe scară largă în industria cărămizilor și sticlei . În chimie, este produsul inițial pentru obținerea permanganatului de potasiu (KMnO 4 ) și a tuturor celorlalți compuși de mangan. În sinteza organică este utilizat pe scară largă ca oxidant .
fundal
Pictorii de stânci din antichitate și mai târziu vechii egipteni au folosit MnO 2 ca pigment negru sau maro. Una dintre primele utilizări a fost în fabricarea sticlei. Analizele efectuate pe sticlă de către romani și egipteni au constatat prezența a peste 2% din oxid de mangan. Pliniu relatează că romanii au folosit oxid de mangan (numit „magneziu”) pentru a decolora sticla. El a considerat-o ca o varietate de magnetit , un mineral magnetic de fier. [3]
Piroluzitul a continuat să fie confundat cu un oxid de fier până în 1740, când JH Pott a demonstrat că nu conține fier și că a dat naștere unei serii bine definite de săruri. În 1774 Carl Wilhelm Scheele a dovedit că este un oxid de metal și l-a folosit pentru a descoperi clorul. MnO 2 a fost folosit în secolul al XVIII-lea pentru producerea de clor . Dioxidul de mangan a fost apoi recuperat prin procesul Weldon . Ulterior această tehnologie a fost abandonată, iar clorul este produs în prezent prin metode electrolitice. În 1868 Georges Leclanché a inventat prima celulă uscată în care MnO 2 este utilizat ca oxidant. [4]
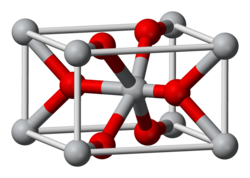
Structura
Dioxidul de mangan este adesea nestoiometric . Diverse MnO 2 polimorfe au fost identificate. Cel mai comun este β-MnO 2, ( pirolusit ) , care are o structură similară cu cea a rutil , TiO 2. [5] Alte polimorfi α-MnO 2, γ-MnO 2, ε-MnO 2 și λ-MnO 2. [5] [6] Structurile tuturor acestor forme sunt similare și se bazează pe octaedre MnO 6 conectate; în toate cazurile, cu excepția β-MnO 2, există tuneluri care pot conține cationi. [5] [6]
Reactivitate
MnO 2 este insolubil în apă, și este , de asemenea , destul de inert cu majoritatea acizilor , la temperatura camerei. La încălzire, acesta reacționează ca oxidant, cu reacții diferite în funcție de acidul utilizat. Cu acid clorhidric (HCl) se dezvoltă clor; este cel mai simplu mod de a prepara cantități mici de clor în laborator:
Cu acid sulfuric fierbinte concentrat se reduce manganul și se dezvoltă oxigenul: [2]
Prin supunerea MnO 2 la fuziune alcalină oxidantă (topită la cald cu baze puternice precum hidroxidul de potasiu (KOH) în prezența oxidanților sau oxigenului) se obține ionul manganat (MnO 4 2− ), de culoare verde închis. Acest lucru este destul de stabil în soluția bazică, în timp ce în soluția acidă neutră sau dismutată :
Ionul permanganat (MnO 4 - ) nu este stabil, de asemenea, la nesfârșit în soluție și se reduce lent la MnO 2 formând oxigen:
Dioxidul de mangan catalizează, de asemenea, descompunerea peroxidului de hidrogen (H 2 O 2 ) în oxigen și apă:
Utilizări
Lână
În prezent, utilizarea principală a MnO 2 este ca componentă oxidantă atât în celulele uscate clasice , cât și în cele mai moderne baterii alcaline . Pentru această utilizare în 1976, au fost folosite 500.000 de tone de piroluzită. [2] Bateriile nu utilizează MnO 2 de origine naturală, ci de sinteză. Există două forme sintetice distincte: dioxid de mangan chimic (CMD = dioxid de mangan chimic) și dioxid de mangan electrolitic (EMD = dioxid de mangan electrolitic). [7]
Cărămizi
O altă utilizare importantă a MnO 2 este în industria cărămizilor pentru a obține cărămizi colorate. [2] Culorile obținute variază de la galben la roșu până la maro până la negru, în funcție de cantitatea de MnO 2 adăugată și de culoarea inițială a materialului argilos. MnO 2 poate fi de asemenea utilizat în amestec cu alți oxizi, cum ar fi oxizii de fier.
Sticlă
Utilizat întotdeauna în industria sticlei, MnO 2 este folosit pentru a „decolora” sticla și, din acest motiv, este cunoscut și sub numele de săpun al fabricanților de sticlă . [2] Sticla este adesea colorată din cauza prezenței inevitabile a unor cantități mici de fier; de exemplu ionul Fe 2+ dă o culoare verde. Adăugarea de MnO 2 la amestecul are două efecte. Un prim efect este oxidarea Fe 2+ la Fe 3+ , care este mult mai puțin colorată. Mai mult, manganul este redus la specii de Mn (III) care au o culoare roșie, complementară cu cea a fierului, astfel încât sticla să pară „incoloră”, chiar dacă în realitate devine gri. Compușii de seleniu și cobalt sunt folosiți în prezent ca înălbitori pentru sticlă.
Precursorul permanganatului
Sinteza industrială a permanganatului de potasiu începe cu topirea alcalină oxidantă a MnO 2 : solidul este amestecat cu o bază puternică precum hidroxidul de potasiu (KOH) și topit la cald în prezența unui oxidant precum azotatul de potasiu (KNO 3 ) sau chiar oxigen: [7]
Manganul este astfel oxidat de la Mn (IV) la Mn (VI), formând ionul manganat verde închis (MnO 4 2− ), care este apoi oxidat electrolitic la Mn (VII) pentru a obține permanganat de potasiu purpuriu întunecat:
Oxidant în sinteza organică
Dioxidul de mangan este adesea folosit ca oxidant în sinteza organică . [8] Eficacitatea reactivului depinde de metoda de preparare, așa cum se întâmplă de obicei în sistemele eterogene, unde suprafața este unul dintre factorii importanți. [9] pirolusit mineral nu este foarte reactiv, și de obicei MnO 2 este preparat prin tratarea unei soluții apoase de KMnO 4 cu o sare de Mn (II), de obicei sulfat. MnO 2 oxideaza astfel obținuți alcoolii alilici la aldehidele corespunzătoare:
-
cis -RCH=CHCH 2 OH + MnO 2 → cis -RCH=CHCHO + “MnO” + H 2 O
Configurația dublei legături este menținută în timpul reacției. O reacție similară poate fi efectuată și cu alcoolii acetilenici corespunzători, dar aldehidele de propargil obținute pot fi foarte reactive. Benzil sau alcoolii inactivați sunt, de asemenea, substraturi adecvate pentru această reacție. 1,2-dioli sunt clivate din MnO 2 la dialdehide sau dicetone. Pe lângă acestea, există numeroase alte aplicații ale MnO 2, care pot fi utilizate în reacții , cum ar fi oxidarea amine și tioli, formarea sistemelor aromatice și cuplare oxidative reacții.
Notă
- ^ foaie de substanță pe IFA-GESTIS
- ^ a b c d e ( EN ) NN Greenwood, A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ^ Zăcămintele de mangan din CE mai dure din Statele Unite, cu secțiuni despre depozitele străine. , în Buletin - United States Geological Survey , 1910, pp. Nota articolului nr. 427. Original de la Universitatea Harvard Digitalizat 24 august 2007.
- ^ Encyclopaedia Britannica ediția a XI-a. 1911 , volume separate în format Djvu și text (în engleză), pe Internet Archive
- ^ a b c ( EN ) AF Wells, Structural Inorganic Chemistry , ed. a V-a, Oxford Science Publications, 1984, ISBN 0-19-855370-6 .
- ^ a b GC Fong, BJ Kennedy, MM Elcombe, Un studiu de difracție cu neutroni în pulbere al λ-MnO 2 și γ-MnO 2 și al LiMn 2 O 4. , în Zeitschrift für Kristallographie , vol. 209, nr. 12, 1994, pp. 941-945.
- ^ a b ( EN ) AR Reidies, „Compuși de mangan” în Enciclopedia Ullmann de chimie industrială , Weinheim, Wiley-VCH, 2005.
- ^ (EN) Cahiez G., M. Alami, RJK Taylor, M. Reid, JS Foot, "Manganese Dioxide" în Encyclopedia of Reagents for Organic Synthesis, editat de L. Paquette, New York, J. Wiley & Sons, 2004 , DOI : 10.1002 / 047084289 .
- ^ J. Attenburrow, AFB Cameron, JH Chapman, RM Evans, BA Hems, ABA Jansen, T. Walker ,, Titlul nu este indicat. , în J. Chem. Soc. , 1952, p. 1094.
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre dioxid de mangan
Wikimedia Commons conține imagini sau alte fișiere despre dioxid de mangan
linkuri externe
- ( EN ) Exemple de reacții folosind MnO 2 , pe organic-chemistry.org .
- ( EN ) Cardul internațional de siguranță chimică 0175 , pe ilo.org .
- ( EN ) Toxicitatea manganului în ceramică, de Elke Blodgett , pe ceramic-materials.com (arhivat din original la 24 noiembrie 2004) .
| Controlul autorității | Tezaur BNCF 31329 |
|---|