Hidrură de sodiu
| Hidrură de sodiu | |
|---|---|
| Numele IUPAC | |
| hidrură de sodiu | |
| Denumiri alternative | |
| hidrură de sodiu | |
| Caracteristici generale | |
| Formula moleculară sau brută | NaH |
| Masa moleculară ( u ) | 24 |
| Aspect | solid cristalin incolor |
| numar CAS | |
| Numărul EINECS | 231-587-3 |
| PubChem | 24758 |
| ZÂMBETE | [H-].[Na+] |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1.20 |
| Solubilitate în apă | reacționează cu apă, insolubilă în solvenți organici |
| Temperatură de topire | 800 ° C (1073,15 K) cu descompunere |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
 | |
| Pericol | |
| Fraze H | 228 - 260 - 314 |
| Sfaturi P | 210 - 223 - 231 + 232 - 280 - 370 + 378 - 422 [1] [2] |
Hidrura de sodiu este un compus chimic cristalin cu formula NaH. Este inflamabil și instabil în aer . Reacționează violent cu apă conform reacției
generând hidrogen foarte inflamabil și exploziv amestecat cu aer.
Utilizarea principală a hidrurii de sodiu profită de calitatea puternică a bazei aplicată sintezei organice . NaH este un reprezentant principal al hidrurilor saline, caracterizate prin legături ionice , care au proprietăți fizico-chimice și reactivitate diferite de hidrurile covalente precum boranul , metanul , amoniacul și apa.
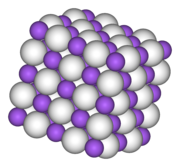
NaH este produs prin reacție directă, exploatând electropozitivitatea ridicată a sodiului , între hidrogen și sodiu topit. Hidrura de sodiu cristalizează, ca toate hidrurile metalelor alcaline , în sistemul cubic centrat pe față cu fiecare ion Na + înconjurat de șase H - . Compusul pur este incolor, tinde să capete o culoare gri.
Hidrura de sodiu este comercializată în mod obișnuit sub formă de suspensie în ulei mineral la 60% din greutate, o stare fizică care permite păstrarea stabilității sale. Reacțiile care implică utilizarea NaH sunt efectuate într-o atmosferă inertă, de exemplu într-o atmosferă de azot .
Utilizare în sinteza organică
NaH este o bază foarte versatilă și utilă în sinteza organică . Este capabil să deprotoneze o gamă largă de acizi Brønsted , chiar și slabi, dând derivații de sodiu corespunzători. Substraturile tipice care reacționează ușor conțin legături -OH, -NH și -SH, cum ar fi alcooli și fenoli , amine , amide și pirazoli , tioli .
Hidrura de sodiu este utilizată pentru deprotonarea compușilor 1,3-dicarbonilici, cum ar fi esterii malonici . Derivatul relativ de sodiu poate fi ulterior alchilat prin reacția cu o halogenură de alchil, de exemplu ( carbonul legat de Na are de fapt o sarcină negativă). NaH este, de asemenea, utilizat pentru a promova reacțiile de condensare între compușii carbonilici prin condensarea Dieckmann , condensarea Stobbe , condensarea Darzens și condensarea Claisen . De asemenea, este utilizat pentru a produce liganzi organometalici .
Hidrura de sodiu reduce legăturile Si-Si ale disilanilor și legăturile SS ale disulfurilor .
Notă
- ^ Fișă informativă hidrură de sodiu pe IFA-GESTIS
- ^ În caz de incendiu, stingeți cu dioxid de carbon.
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe hidrură de sodiu
Wikimedia Commons conține imagini sau alte fișiere pe hidrură de sodiu