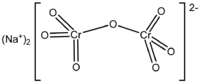
Dicromat de sodiu
| Dicromat de sodiu | |
|---|---|
| Denumiri alternative | |
| dicromat de sodiu | |
| Caracteristici generale | |
| Formula moleculară sau brută | Na 2 Cr 2 O 7 |
| Masa moleculară ( u ) | 261,97 g / mol |
| Aspect | portocaliu solid |
| numar CAS | |
| Numărul EINECS | 234-190-3 |
| PubChem | 25408 |
| ZÂMBETE | [O-][Cr](=O)(=O)O[Cr](=O)(=O)[O-].[Na+].[Na+] |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 2,35 (20 ° C) (dihidrat) |
| Solubilitate în apă | 731,8 g / l (20 ° C) (dihidrat) |
| Temperatură de topire | 356 ° C (629 K) (substanță anhidră) |
| Temperatura de fierbere | 400 ° C (673 K) (descompunere) |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
     | |
| Pericol | |
| Fraze H | 272 - 301 - 312 - 330 - 314 - 317 - 334 - 340 - 372 - 350 -360fd - 410 |
| Sfaturi P | 201 - 273 - 280 - 301 + 330 + 331 - 302 + 352 - 304 + 340 - 305 + 351 + 338 -308 + 310 [1] |
Dicromatul de sodiu este compusul anorganic cu formula Na 2 Cr 2 O 7 . De obicei, totuși, sarea se găsește sub forma dihidrat Na 2 Cr 2 O 7 2 H 2 O. Practic, toate minereurile de crom sunt procesate prin conversie în dicromat de sodiu și practic toți compușii și materialele pe bază de crom sunt preparate din această sare. [2] În ceea ce privește reactivitatea și aspectul, dicromatul de sodiu și dicromatul de potasiu sunt foarte asemănătoare. Sarea de sodiu este totuși de aproximativ douăzeci de ori mai solubilă în apă decât sarea de potasiu (49 g / L la 0 ° C) și greutatea sa echivalentă este, de asemenea, mai mică. [3]
Producție
Dicromatul de sodiu este produs pe scară largă din minerale care conțin oxizi de crom (III) . Mineralul este topit cu o bază, de obicei carbonat de sodiu , la aproximativ 1000 ° C în prezența aerului (sursă de oxigen ):
Această etapă solubilizează cromul și permite extragerea acestuia în apă fierbinte. În acest stadiu, alte componente ale mineralului, cum ar fi compușii de aluminiu și fier , sunt slab solubili. Acidificarea extractului apos rezultat cu acid sulfuric sau dioxid de carbon produce dicromat:
Dicromatul este izolat ca dihidrat prin cristalizare . În acest fel, se produc în fiecare an milioane de kilograme de dicromat de sodiu.
Deoarece cromul (VI) este toxic, în special sub formă de pulbere, astfel de fabrici sunt supuse unor reglementări stricte. De exemplu, efluenții din astfel de rafinării sunt tratați cu agenți reducători pentru a readuce orice crom (VI) la crom (III), care este mai puțin periculos pentru mediu. [2] Se cunosc o varietate de hidrați ai acestei sări, variind de la decahidrat sub 19,5 ° C, precum și hexa-, tetra- și dihidrați. Peste 62 ° C, aceste săruri pierd spontan apă pentru a da materialul anhidru. Se cristalizează la 30-35 ° C.
Reacții
Sărurile dicromat și cromat sunt agenți de oxidare . Pentru tăbăcirea pielii , dicromatul de sodiu este mai întâi redus cu dioxid de sulf .
În sinteza organică , [3] acest compus oxidează legături CH benzil și alil la derivați carbonilici . De exemplu, 2,4,6-trinitrotoluen este oxidat la acidul carboxilic corespunzător. [4] In mod similar, 2,3-dimethylnaphthalene este oxidat de Na 2 Cr 2 O 7 la acid 2,3-naphthalendicarboxylic. [5]
Alcoolii secundari sunt oxidați la cetona corespunzătoare, de ex. mentol la menton ; [6] dihidrocolesterol în colestanonă: [7]
Comparativ cu sarea de potasiu, principalul avantaj al dicromatului de sodiu este solubilitatea sa mai mare în apă și solvenți polari, cum ar fi acidul acetic .
Dicromatul de sodiu poate fi utilizat în conversia fluorenului în fluorenonă .
Siguranță
Ca toți compușii hexavalenți ai cromului, dicromatul de sodiu este cancerigen . [8] De asemenea, compusul este coroziv și expunerea poate provoca leziuni oculare grave sau orbire. [9] Expunerea prelungită poate provoca, de asemenea, afectarea fertilității, afectarea genetică ereditară și vătămarea fetală.
Notă
- ^ Fișă informativă cu dicromat de sodiu pe IFA-GESTIS Arhivat 16 octombrie 2019 la Internet Archive .
- ^ a b Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger, "Chromium Compounds" în Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI : 10.1002 / 14356007.a07_067
- ^ a b Freeman, F. „Dicromat de sodiu” în Enciclopedia reactivilor pentru sinteza organică (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI : 10.1002 / 047084289 .
- ^ (EN) Sinteze organice , http://www.orgsyn.org/demo.aspx?prep=cv1p0543
- ^ (RO) Sinteze organice , http://www.orgsyn.org/demo.aspx?prep=cv5p0810
- ^ (EN) Sinteze organice , vol. 9, http://www.orgsyn.org/demo.aspx?prep=cv1p0340 .
- ^ (RO) Sinteze organice , http://www.orgsyn.org/demo.aspx?prep=cv2p0139
- ^ IARC , Volumul 100C: Arsenic, metale, fibre și praf ( PDF ), Lyon, Agenția Internațională pentru Cercetarea Cancerului, 2012 [17-24 martie 2009] , ISBN 978-92-832-0135-9 . Adus la 5 ianuarie 2020 (Arhivat din original la 17 martie 2020) .
„Există suficiente dovezi la om pentru carcinogenitatea compușilor de crom (VI). Compușii cu crom (VI) provoacă cancer la plămâni. De asemenea, s-au observat asociații pozitive între expunerea la compuși ai cromului (VI) și cancerul nasului și sinusurilor nazale. Există suficiente dovezi la animalele experimentale pentru carcinogenitatea compușilor de crom (VI). Compușii cu crom (VI) sunt cancerigeni pentru oameni (grupa 1) . " . - ^ ILO 1369 - Dicromat de sodiu
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre dicromat de sodiu
Wikimedia Commons conține imagini sau alte fișiere despre dicromat de sodiu
linkuri externe
- (EN)dicromat de sodiu , al Enciclopediei Britannice , Encyclopædia Britannica, Inc.