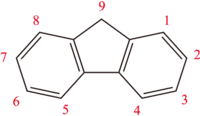
Fluoren
| Fluoren | |
|---|---|
| Numele IUPAC | |
| 9 H- fluor | |
| Denumiri alternative | |
| difenilenetan metan HSDB 2165 difenilen-NSC 6787 sau -bifenilenetan 2,2'-metilenebifenil | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 13 H 10 |
| Masa moleculară ( u ) | 166.223 |
| Aspect | solid cristalin alb |
| numar CAS | |
| Numărul EINECS | 201-695-5 |
| PubChem | 6853 |
| ZÂMBETE | C1C2=CC=CC=C2C3=CC=CC=C31 |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1.202 |
| Constanta de disociere a acidului la 293 K. | 2,51 * 10 −23 |
| Temperatură de topire | 116-117 ° C |
| Temperatura de fierbere | 295 |
| Informații de siguranță | |
| Punct de flacără | > 93 ° C |
| Simboluri de pericol chimic | |
 | |
| Atenţie | |
| Fraze H | 410 |
| Sfaturi P | 273 [1] |
Fluorul este o hidrocarbură policiclică aromatică având formula moleculară C 13 H 10 .
Caracteristici generale
La temperatura camerei și presiunea atmosferică apare sub formă de cristale albe, cu miros similar cu naftalina . Are o fluorescență violet (de aici și numele) și este combustibil . Este insolubil în apă , în timp ce este solubil în benzen și dietil eter . Molecula de fluoren este aproape plană [2] , de fapt fiecare dintre cele două inele de benzen este coplanară cu carbonul central (numărul 9) [3] .
Proprietate
Fluorul are caracteristici acide ușoare, de fapt hidrogenii carbonului 9 sunt slab acizi (pK a = 22,6 în dimetil sulfoxid [4] ). Deprotonarea conferă anionului fluorenil stabil (C 13 H 9 - ), care este aromat și are o culoare portocalie intensă. Anionul este un nucleofil și mulți compuși electrofili reacționează cu acesta, adăugându-se la carbonul 9. Purificarea fluorenei profită de aciditatea sa și de solubilitatea redusă a derivaților săi de sodiu din hidrocarburi. Ambii protoni pot fi eliminați din carbonul 9. De exemplu, 9,9-dipotasiu-fluorenil poate fi obținut prin tratarea fluorenului cu potasiu metalic în dioxanul în fierbere [5] .
Utilizări și producție
Se obține în general din gudron, dar poate fi produs și prin dehidrogenarea difenilmetanului [6] .
Fluorul este utilizat în producția de medicamente aromatice , tincturi și poliamide . Compușii derivați din fluoren au multe aplicații. Acidul 9-flurenoic, un acid carboxilic , este utilizat la prepararea medicamentelor. 2-aminofluoren , 3,6-bis-dimetilaminofluoren și 2,7-diiodiofluoren sunt utilizate în procesele de producere a coloranților. Oxidarea fluorenei dă fluorenonă , care este nitrată pentru a da compuși utili comercial. 9-fluorenilmetil-cloroformiat (Fmoc clorat) este utilizat pentru a introduce 9-fluorenilmetil carbamat pe amine în sinteza peptidelor [6] .
Fluorul dă naștere, de asemenea, la polimeri (polifluoreni). În polifluoren, carbonul 7 al unei unități este legat de carbonul 2 al altei unități, net de doi atomi de hidrogen, acest polimer este capabil să conducă electricitatea și are proprietăți de fotoluminiscență și electroluminescență , de fapt a fost mult timp studiat pentru aplicații în domeniul OLED-uri (diodă organică emițătoare de lumină).
Toxicitate
Studiile efectuate pe șobolani (expuse la 0, 125, 250 sau 500 mg / kg pe zi timp de 13 săptămâni) arată: salivare crescută, hipoactivitate; procentul de prezență a următoarelor simptome este legat de cantitatea eliberată. Respirația dificilă și blefaroptoza (pleoapele căzute) au fost înregistrate la o concentrație ridicată [7] . La femeile tratate cu 250 mg / kg / zi de fluoren, există o scădere semnificativă a globulelor roșii, scăderea hemoglobinei și o creștere a nivelului de bilirubină . Cu toate acestea, aceste simptome, chiar dacă depind de cantitatea administrată, nu sunt semnificative statistic.
Un studiu asupra aspectelor cancerigene ale fluorenei efectuat de Wilson în 1947 a introdus diferite concentrații ale compusului în dieta a două grupuri de șobolani albini. O parte din șobolani au fost expuși la concentrații mari (între 0,062% și 1%) timp de 104 zile. A existat o reducere semnificativă a ritmului lor de creștere, dar în alte privințe, nimic semnificativ. [7] A doua parte a șobolanilor li s-a administrat 0,12% până la 0,5% fluoren în dietă timp de 453 de zile și doar un șobolan a dezvoltat un mic adenom tubular benign într-un rinichi. [7] Numărul total de animale testate nu a fost indicat.
Studiile efectuate pe pisici arată o scădere a greutății (atât pentru bărbați, cât și pentru femei), pentru doze mari a fost înregistrată afectarea splinei și a rinichilor , însoțită de o creștere histopatologică a cantității de hemosiderină din splină și celulele Kupffer ale ficatului [ 7] . Mai mult, după șapte injecții subcutanate cu 10 mg fluoren la zece pisici, nu au fost detectate locuri tumorale. [8]
Imagini 3D ale moleculei

Notă
- ^ Sigma-Aldrich; rev. din 12.05.2014
- ^ DM Burns, John Iball (1954), Structura moleculară a naturii fluorenei volumul 173, p. 635. DOI : 10.1038 / 173635a0
- ^ RE Gerkin, AP Lundstedt și WJ Reppart (1984) Structura fluorenei, C 13 H 10 , la 159 K Acta Crystallographica, volumul C40, pp. 1892–1894 DOI : 10.1107 / S0108270184009963
- ^ FG Bordwell, Acidități de echilibru în soluție de dimetil sulfoxid , în Acc. Chem. Rez. , 1988, pp. 456-463, DOI : 10.1021 / ar00156a004 .
- ^ GW Scherf și RK Brown (1960), DERIVAȚI POTASICI DE FLUORENE CA INTERMEDIAȚI ÎN PREGĂTIREA FLUORENILOR SUBSTITUITE C9. I. PREGĂTIREA POTASIULUI DE 9-FLUORENIL ȘI SPECTRA INFRAROZĂ DE FLUORENE ȘI UNELE FLUORENE C9-SUBSTITUITE Arhivat la 16 decembrie 2012 în Archive.is . . Revista canadiană de chimie, vol. 38, p. 697.
- ^ a b Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke „Hidrocarburi” în Ullmann's Encyclopedia of Industrial Chemistry 2002 Wiley-VCH, Weinheim. DOI : 10.1002 / 14356007.a13_227
- ^ a b c d US EPA. 1989. Studiu de toxicitate subcronică orală la șoarece . Pregătit de Toxicity Research Laboratories, LTD., Muskegon, MI pentru Office of Solid Waste, Washington, DC.
- ^ Shear, 1983
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe fluoren
Wikimedia Commons conține imagini sau alte fișiere pe fluoren
linkuri externe
- ( EN ) Inventarul Național al Poluanților - Fișă informativă privind hidrocarburile policiclice aromatice , pe npi.gov.au. Adus la 15 martie 2010 (arhivat din original la 18 mai 2006) .
- (EN) Fluoren în baza de date Institutul Național de Standarde și Tehnologie.