Țesutul endotelial
Acest articol sau secțiune despre anatomie nu menționează sursele necesare sau cele insuficiente. |
| Țesutul endotelial | |
|---|---|
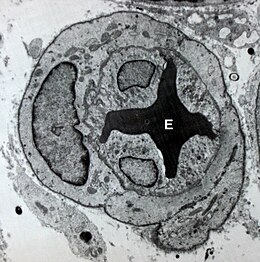
| Celulele endoteliale ale capilarului. E = eritrocit | |
| Identificatori | |
| Plasă | A10.272.491 |
| FMA | 63916 |
| TU | H2.00.02.0.02003 |
Țesutul endotelial este un anumit tip de țesut epitelial non-stratificat de trotuar [1] [2] de derivare mezenchimală care constituie monostratul celular care acoperă suprafața internă a vaselor de sânge , a limfaticelor și a inimii ( endocard ). [3] Endoteliul este cel mai voluminos țesut din corpul uman, are o greutate totală de 1,0-1,8 kg și o suprafață estimată de aproximativ 400 m 2 (conform altor autori 1000 m 2 ). [4] [5]
Generalitate
Celulele care formează endoteliul se numesc celule endoteliale: celule endoteliale vasculare, dacă sunt în contact cu sângele, și celule endoteliale limfatice, dacă sunt în contact cu limfa. Celulele endoteliale vasculare se găsesc în întregul sistem circulator , de la inimă la vene și sunt expuse atât fluxului sanguin, cât și constituenților plasmatici. Structura lor prezintă variații (eterogenitatea endoteliului) în funcție de diferitele compartimente de care aparțin (arteriale, venoase și capilare). Există diferențe notabile în celulele endoteliale care sunt responsabile pentru funcțiile speciale de filtrare; exemple de astfel de structuri pot fi găsite în glomerulii renali și în bariera hematoencefalică .
Endoteliul constituie o barieră anatomică între sânge și tunica intimă a vaselor sau, în cazul capilarelor, între sânge și spațiul țesutului interstițial: este atât o barieră fizică semipermeabilă, cât și o interfață biologică capabilă să răspundă la semnale chimice și mecanice generate de cele două compartimente (sânge și țesut) între care se interpune endoteliul (vezi Patbiologia aterosclerozei : endoteliu și stres mecanic).
Celulele endoteliale îndeplinesc mai multe funcții de primă importanță pentru biologia vasculară și pentru menținerea homeostaziei întregului organism. Unele dintre aceste funcții sunt mediate de secreția locală ( secreția paracrină ) sau sistemică ( secreția endocrină ) a mediatorilor chimici (de exemplu, autacoizi , citokine ) și hormoni (de exemplu, endotelina ).
Funcțiile endoteliului includ:
- reglarea permeabilității vasculare;
- reglarea tonului și structurii vaselor;
- angiogeneza ;
- controlul hemostazei ;
- controlul inflamației (de exemplu, recrutarea neutrofilelor );
- funcții endocrino-metabolice (de exemplu, metabolismul lipoproteinelor și al unor hormoni ).
Etimologie
Încă în 1856, în marele tratat al lui Todd și Bowman ( Anatomia fiziologică și fiziologia omului ), căptușeala interioară a vaselor a fost denumită „stratul epitelial”. Primul care a recunoscut, cu metoda de impregnare a argintului, că capilarele nu sunt simple treceri membranare prin țesuturi, ci au propriul lor perete celular, a fost Friedrich Daniel von Recklinghausen în 1860; termenul endoteliu (din grecescul endo -, intern și telé , mamelon, datorită similarității cu căptușeala internă a mamelonului) a fost propus de elvețianul Wilhelm His senior (1831-1904) în 1865, în timpul cercetărilor sale din câmp embriologic, pentru indică căptușeala internă a vaselor și cavitățile pleurale și peritoneale ( mezoteliul actual), distingându-l de epiteliul care constituie căptușeala structurilor anatomice în contact cu mediul extern. [6] [7]
Clasificare
Pe baza tipului de contact care se stabilește între celulele endoteliale, endoteliul este clasificat ca fiind continuu, fenestrat și discontinuu. Endoteliul continuu se găsește în endocard, în tunica intimă a arterelor și venelor și în numeroase districte capilare (cutanate, musculare, pulmonare, cerebrale, spinale și reitinale), în timp ce celelalte tipuri sunt exclusive unor paturi capilare : endoteliul fenestrat capilare renale și glomerulare, glande exocrine și endocrine, vilozități intestinale și plexuri coroidiene; endoteliu discontinuu al sinusoidelor hepatice, splenice și medulare.
Anatomie microscopică
Celula endotelială este o celulă de podea mononucleară, cu o formă poligonală alungită, cu o prevalență a morfologiei alungite în artere și cea poligonală în vene. Forma alungită, orientată în funcție de direcția fluxului sanguin, domină acolo unde fluxul este rapid, unidirecțional și laminar, în timp ce este mai puțin evident în secțiunile de flux lent și perturbat. Grosimea medie a celulelor endoteliale variază de la 0,1-0,2 μ în capilare și vene la 1 μ în aortă și este maximă la nivelul nucleului (2-3 μ); lungimea este în jur de 30-50 μ și lățimea este de 10-20 μ. Nucleul este ovoid și alungit, iar citoplasma conține, pe lângă organitele obișnuite ( Golgi , mitocondrii , reticul endoplasmatic , ribozomi , lizozomi și citoschelet ), numeroase vezicule (deosebit de abundente în capilare, unde constituie aproximativ 20% din celulă volum) și Bodies de Weibel-Palade (WPB). Celulele endoteliale sunt celule polarizate, deoarece suprafața luminală este diferită de suprafața abluminală (bazală).
Vezicule. Există atât clathrin- vezicule acoperite și vezicule neacoperite conținând caveolin și Cavina. [8] Primul implicat în „ endocitoză , care servește ca funcție de transport intracelular, de la membrana plasmatică la endozomi până la aparatul Golgi sau, ca în cazul transferinei mediate de receptorul endocitozei și lipoproteinelor cu densitate mică (LDL ). Acestea din urmă sunt mult mai numeroase, au un diametru de 50–70 nm și sunt responsabile de transportul substanțelor prin celula endotelială ( transcitoză ); sunt deosebit de numeroase în capilarele nefenestrate: [9] densitatea lor variază de la 200 / μm 3 în arteriole la 600 / μm 3 în venulele postcapilare, până la 900-1200 / μm 3 în capilare, cu excepția unor paturi capilare, cum ar fi ca cele ale plămânilor (130 / μm 3 ) și mai ales bariera hematoencefalică (<100 / μm 3 ). [10] În timp ce endocitoza îndeplinește sarcina de a furniza celulelor substanțe destinate propriului său metabolism, transcitoza intervine în transferul compușilor destinați mediului extracelular.
Corpurile Weibel-Palade . WPB-urile sunt vezicule secretoare, specifice celulelor endoteliale, care la microscopul electronic par alungite (în formă de tijă ), cu dimensiuni de aproximativ 0,2 x 2 μ, electrondense și striate în mod regulat datorită prezenței unor structuri tubulare paralele, formate din polimeri de factorul Von Willebrand (VWF). [11] Pe lângă VWF, corpurile WPB conțin proteina adezivă P-selectină .
Principalele diferențe morfologice dintre endoteliul arterial și venos se referă în principal la: grosimea celulei (mai mică în vene, cu excepția HEV sau a venulelor post-capilare cu un endoteliu ridicat al ganglionilor limfatici ); dezvoltarea sistemelor joncționale (mult mai puțin strânse în vene, în special în venulele post-capilare); abundența veziculelor citoplasmatice (prezența organelor veziculo-vacuolare sau VVO în venulele post-capilare). Aceste diferențe structurale sunt legate de permeabilitatea și parametrii hemodinamici (stress fricțional sau tensiune de forfecare este de 1-5 dyn / cm2 în sectorul venos și 10-40 dyne / cm 2 în sectorul arterial) [12] (Vezi Pathbiology de Ateroscleroza - Stresul hemodinamic).
Suprafața celulei
Suprafața luminală are numeroase gropițe în formă de balon, denumite caveole (lett. Caverne mici) [13] și este „acoperită” de glicocalix și de stratul de suprafață endotelial (ESL, stratul superficial endotelial). Cavernele, invaginate, dau naștere la vezicule care conțin caveolină. Glicocalixul este un strat de glicoproteină cu grosime variabilă în funcție de starea funcțională a celulei (în medie măsoară aproximativ 60-110 nm). Această acoperire este bogată în sarcini negative și este formată din glicoproteine (de exemplu, molecule de aderență , molecule ale sistemului hemostatic ), heparan sulfat-proteoglicani (de exemplu, sindecan, glic) și glicolipide de membrană: componenta glucozică a acestor molecule iese din suprafața membrana celulară (vezi Patbiologia aterosclerozei - Proteoglicani). Moleculele plasmatice aderă la glicocalixul luminal formând un strat gros (500-1000 nm) care acoperă glicocalixul și care este denumit ESL. Atât glicocalixul, cât și ESL au o importanță funcțională considerabilă: acționează ca un filtru molecular (influențând permeabilitatea), modulează stresul de forfecare și inhibă aderența leucocitelor și a trombocitelor . [14] În vasele mici și capilare, prezența acestui strat mărește rezistența la curgere și respinge globulele roșii , atât de mult încât în capilare hematocritul are valori mai mici decât valorile sistemice. În timpul proceselor inflamatorii, glicocalixul este reprimat, contribuind la aderența leucocitelor la endoteliu.
Suprafața bazală are, de asemenea, numeroase caveole și este ferm ancorată de membrana bazală a tunicii intime . Această ancorare este opera a două clase de proteine care mediază aderența matricei extracelulare celulare (ECM): integrine și hepatan sulfat-proteoglicanii menționați anterior; aproape toate proteinele care alcătuiesc ECM posedă site-uri de legare pentru ambele două clase. [15] [16] Integrinele și sindecanii au un domeniu extracelular (care se leagă de ECM), un domeniu transmembranar (care traversează membrana celulară) și un domeniu intracelular (care interacționează cu citoscheletul). În acest fel, aceste proteine adezive acționează și ca mecanoreceptoare: răspund la deformare și transmit semnale din mediul extracelular din interiorul celulei. Ele pot fi organizate în complexe structurale plurimoleculare, numite „ aderențe focale ”. Adeziunile focale apar ca mici regiuni electrondense ale membranei, de formă alungită, cu un diametru mai mare de câțiva microni, aderând îndeaproape la ECM și conectate direct la citoschelet . [17] Cadrul lor de susținere este alcătuit din integrine, dar peste o sută de proteine diferite, inclusiv sindecani, participă la formarea lor. Adeziunile focale sunt complexe dinamice, care sunt asamblate și dezasamblate în funcție de nevoile funcționale.
Citoschelet
Citoscheletul este format din filamente de actină și proteine asociate ( miozină , vinculină etc.). La microscopul electronic , citoscheletul pare să fie organizat în trei sisteme fundamentale: o rețea periferică de filamente situate chiar sub membrana plasmatică; o îngroșare submembranoasă a microfilamentelor la suprafața bazală și la joncțiunile intercelulare; fibre de stres (mănunchiuri de microfilamente) conectate atât cu aderențele focale ale membranei plasmatice bazale, cât și cu membrana apicală. [18] Citoscheletul este important pentru menținerea morfologiei celulare, pentru stabilizarea integrității structurilor de aderență și pentru modularea permeabilității endoteliale. [19] Reorganizarea citoscheletului ca răspuns la solicitări hemodinamice este însoțită de modificări ale formei celulare. Expunerea la stres de forfecare ridicat induce o dezvoltare mai mare a fibrelor de stres, o dezvoltare mai mică a rețelei periferice de filamente și o alungire a formei celulare; stresul mic de forfecare are un efect opus asupra organizării microfilamentelor și determină asumarea formei poligonale. [20]
Cili primari
În unele condiții particulare, cilii primari solitari (cilii imobile) au fost descriși pe suprafața endotelială. [21] [22] [23] Cilii primari au o lungime de 1-5 μ și se caracterizează printr-o structură internă ( axonem ) formată doar dintr-o coroană periferică de nouă perechi de microtubuli , fără perechea centrală de microtubuli (structură "9 + 0") care distinge cele mai comune ciluri mobile (structura "9 + 2"). Aceștia îndeplinesc o funcție mecanoreceptoare: sunt capabili să răspundă la forțe hemodinamice extrem de scăzute (0,007 dyne / cm 2 ) și transmit semnale chimice (de exemplu Ca +2 ) și mecanice în interiorul celulei. [24] Proteinele din membrană policistina 1 și 2 și poliductina / fibrocistina (proteină legată de dezvoltarea rinichiului polichistic) contribuie la geneza primului. Semnalele mecanice sunt transmise în schimb de microtubulii axonemului către citoscheletul citoplasmatic. Cili primari răspund, de asemenea, la forțele mecanice generate în matricea extracelulară (ECM) datorită conexiunii dintre aderențele focale și citoschelet. [25] Se crede că cilii primari sunt exprimați doar în prezența unui stres de forfecare deosebit de scăzut și s-a emis ipoteza că ar putea interveni în dezvoltarea aterosclerozei.
Joncțiuni intercelulare
În endoteliul continuu, celulele endoteliale sunt separate de spații intercelulare înguste de aproximativ 15-20 nm lățime, ocupate de glicozaminoglicanii („cimentul” intercelular istoric). Între celulele endoteliale adiacente se stabilesc, de asemenea, zone circumscrise de contact mai strâns, în care celulele aderă intim una la cealaltă, creând astfel o barieră anatomică dinamică care limitează răspândirea moleculelor de plasmă. Structurile macromoleculare responsabile de această aderență intimă sunt indicate ca „complexe joncționale” ( joncțiuni celulare ), împărțite în: joncțiuni aderente , joncțiuni ocluzive ( joncțiuni strânse ) și joncțiuni comunicante ( joncțiuni gap ). Joncțiunile strânse sunt mai numeroase în sectorul arterial al circulației (dezvoltate în special în endoteliul marilor artere); în capilare se observă dezvoltarea maximă în sistemul nervos central (bariera hematoencefalică); în venulele post-capilare sunt absente. [9] Joncțiunile gap permit comunicarea intercitoplasmatică între celulele endoteliale prin trecerea unor solute mici (mw <1000-1500 daltoni), cum ar fi ioni, metaboliți și al doilea mesager; sunt compuse din conexina Cx37, CX40 și Cx43 că fomano canale ( conexon ) în membrană. Connexin 43 (Cx43) pare să predomine în locurile de flux perturbat. [26]
Joncțiunile-mio endoteliale (MEJ) sunt proeminente ale membranei plasmatice bazale care, împingând prin discontinuități lamina elastică internă, pune celulele endoteliale în comunicare directă cu celulele musculare netede ale presei , permițând o coordonare funcțională precisă între aceste celule . [27] Tocmai din acest motiv, MEJ-urile sunt mai numeroase în arterele de rezistență mici (unde reglarea endotelială a tonusului vascular este mai importantă) decât în arterele de conducere mari. În MEJ-uri există joncțiuni care permit cuplarea electrochimică între endoteliu și musculatura vasculară. [28]
Fiziologie
Endoteliul este un organ endocrin , paracrin și autocrin capabil să elibereze o mare varietate de substanțe în sânge și spațiul interstițial, care poate acționa la distanță (activitate endocrină), asupra celulelor vecine (activitate paracrină) sau asupra aceleiași celule care a produs ei (activitate autocrină). Substanțele produse de endoteliu includ compuși vasoactivi, factori de creștere , mediatori inflamatori ( citokine , chemokine ), molecule de aderență , molecule ale substanței extracelulare, proteine ale sistemului hemostatic, enzime . Prin această gamă largă de compuși endoteliul intervine în controlul homeostaziei vasculare, inflamației , imunității , hemostazei și îndeplinește o serie de funcții metabolice importante. Una dintre cele mai izbitoare demonstrații a importanței endoteliului se obține din faptul că aplicarea acetilcolinei pe suprafața intimă determină dilatarea vasului, în timp ce după îndepărtarea endoteliului aplicația provoacă vasoconstricție. Acest paradox aparent își explică faptul că vasodilatația este determinată de acțiunea acetilcolinei asupra endoteliului, în timp ce vasoconstricția se datorează stimulării directe a celulelor musculare netede.
Activitatea secretorie a endoteliului este atât constitutivă (bazală), cât și inductibilă ca răspuns la diferiți stimuli: datorită poziției sale la interfața dintre sânge și peretele / țesutul vasului, endoteliul este capabil să răspundă la modificările fluxului, la moleculele de plasmă. , celule sanguine și stimuli din mediul subendotelial.
Pentru fiziopatologia endoteliului vezi Disfuncția endotelială .
Permeabilitate
Endoteliul continuu acționează ca o barieră semipermeabilă: limitează trecerea celulelor sanguine și a proteinelor plasmatice , dar permite trecerea solutilor mici, către care permeabilitatea variază atât în funcție de solubilitatea moleculelor din grăsimi și apă, cât și de dimensiunea acestora (moleculară raza, domnule ). Cu excepția barierei hematoencefalice , endoteliile continue ne-fenestrate sunt liber permeabile la apă, substanțe dizolvate liposolubile și compuși mici solubili în apă , în timp ce sunt greu de traversat de macromolecule .
Endotelele continue se comportă ca și când ar avea două tipuri de pori funcționali (teoria cu doi pori): [29] [30] „pori mici” cu un diametru de aproximativ 8-10 nm (conform lui Guyton diametrul este de 6-7 nm) [31] care permit trecerea numai la substanțe dizolvate de M r <3 nm și „pori mari” cu un diametru de aproximativ 40-60 nm pentru trecerea macromoleculelor de M r > 3,6 nm. În capilarele mușchilor scheletici raportul numeric dintre „porii” mici și mari este de aproximativ 4000: 1. Studiile de microscopie electronică au indicat, ca echivalenți morfologici ai „porilor funcționali mici”, spațiile intercelulare cu sistemele lor joncționale, în timp ce caveolele / veziculele neacoperite și canalele intracelulare (canalele tubular-veziculare ), [32] formate din secvența veziculelor comunicarea între ei, ar corespunde „porilor mari”.
Pe baza acestor dovezi, se crede că trecerea apei și a substanțelor dizolvate prin endoteliu are loc de-a lungul a două căi: prin spațiile intercelulare (fisuri) (calea paracelulară) sau prin celulele endoteliale în sine (calea transcelulară). [33] 60% din apă (pm 18 și M r 0,12 nm) filtrează pe calea paracelulară, dar pentru restul de 40% folosește calea transcelulară, utilizând totuși calea specifică constituită de proteinele membranei acvaporinei . [29]
Substanțele liposolubile, cum ar fi oxigenul și dioxidul de carbon, sunt capabile să traverseze membrana plasmatică direct, astfel încât trecerea lor are loc foarte rapid prin difuzie prin celulele endoteliale.
Molecule mici solubile în apă, cu pm <40.000 daltoni și M r <3 nm, cum ar fi apă, monozaharide (glucoză, manitol, fructoză), aminoacizi , uree și proteine mici ( mioglobină : pm 17.600 și M r 2 nm), trece cu ușurință de-a lungul căii paracelulare; răspândirea lor are loc rapid, deși fisurile interendoteliale alcătuiesc doar 1/1000 din întreaga suprafață endotelială.
Macromolecule de pm> 60.000 și M r > 3,6 nm ( hemoglobină pm 68.000 și M r 3,2 nm; albumină pm 69.000 și M r 3,6 nm; HDL pm 180.000-360.000 și medie M r 4.5 nm; IgM pm 950.000 și M r 11,5 nm;LDL în medie pm 2.300.000 și M r 9-13 nm) în condiții fiziologice sunt transportate activ (cu cheltuială de energie) de calea transcelulară constituită de veziculele citoplasmatice ( transcitoză ). [34] În ceea ce privește insulina (pm 6000) din lucrările publicate până în prezent, se pare că celulele endoteliale aortice transportă hormonul cu un proces dependent de receptor care implică caveole, în timp ce endoteliul de microcirculare folosește vezicule acoperite cu clatrin. [35] Deoarece veziculele responsabile de transcitoză au un diametru de aproximativ 100 nm, în special moleculele mari ( M r > 35-40 nm) nu pot traversa endoteliul continuu. Această situație apare pentru lipoproteinele mai voluminoase ( chilomicroni și lipoproteine cu densitate foarte mică sau VLDL ), în timp ce produsul metabolismului lor, adică lipoproteinele cu densitate intermediară ( IDL , M r 25-35 nm), mențin capacitatea de a trece bariera endotelială. (vezi Lipoproteina ). Acest lucru explică de ce hipercilomicronemia nu reprezintă o condiție de risc de ateroscleroză .
În special, pentru LDL există două moduri de transport: [36] cel mediat de clatrin, care captează LDL pentru nevoile metabolice ale celulei, și cel dependent de caveolin, care le transportă către spațiul subendotelial: clatrin- endocitoza mediată utilizează receptorul LDL natural (LDLR) și este reglementată de necesitatea celulară de colesterol; pe de altă parte, transcitoza LDL de către caveole este independentă de nevoile celulare și poate fi independentă de receptor (endocitoză în fază fluidă sau pinocitoză) sau dependentă de receptorul scavenger SR-B1, care este capabil să lege atât LDL modificat cât și modificat natural. [34] [37] Unii au susținut că transcitoza lipoproteinelor ar putea apărea și prin intermediul veziculelor acoperite cu clatrin. [38] Predrescu a identificat un sistem suplimentar de transfer LDL care implică exocitoza mediată de receptorul SNAP (SNARE). [39]
Datorită semi-permeabilității sale, endoteliul controlează cantitatea și compoziția lichidului interstițial prezent în țesuturi, inclusiv peretele vasului. Deoarece lichidul interstițial este mediul fizic care leagă sângele de celule, permeabilitatea endoteliului îndeplinește o funcție vitală pentru organism, permițând pe de o parte intrarea în țesuturi a hormonilor și a metaboliților și, pe de altă parte, îndepărtarea produselor de catabolism . Permeabilitatea este o funcție dinamică care este modulată în funcție de necesitățile fiziologice și de condițiile patologice, ca în cazul reacțiilor inflamatorii, în care permeabilitatea endotelială crește enorm. De fapt, mediatorii inflamației , prin legarea la propriii receptori, determină rearanjarea joncțiunilor intercelulare, astfel încât macromoleculele să poată traversa cu ușurință endoteliul pe calea paracelulară. Chiar și în tumori, capilarele și venulele sunt hiperpermeabile la macromolecule datorită secreției de citokine tumorale (de exemplu, factorul de creștere endotelial vascular sau VEGF).
O importanță deosebită este trecerea albuminei . Deoarece albumina este cea mai abundentă proteină plasmatică, filtrarea corectă a acesteia este esențială pentru menținerea presiunii coloid-osmotice a spațiului extravasal (aproximativ 60% din albumina totală se găsește în spațiul interstițial). Trecerea sa a barierei endoteliale are loc prin transcitoza dependentă de receptor: glicoproteina gp60 sau albondina ( proteina de legare a albuminei ) prezentă în caveole. Deoarece albumina plasmatică este vehiculul pentru transportul a numeroase substanțe insolubile în apă în sânge, compuși precum vitaminele liposolubile , acizii grași cu lanț lung și hormonii steroizi sunt, de asemenea, transportați cu transcitoza albuminei.
Pentru forțele fizice care determină mișcarea apei și a substanțelor dizolvate prin endoteliul capilarelor, consultați Schimburile capilare și ecuația Starling .
Via Transcellulare
Macromoleculele traversează endoteliul prin transcitoză, proces care este mediat de sistemul caveole-veziculă neacoperit și de sistemul Vesiculo-vacuolar VVO ( organele veziculo-vascuolare ).
Așa cum este descris în Anatomia microscopică, caveolele sunt invaginații ale membranei plasmatice („gropițe”) cu diametrul de aproximativ 50-100 nm. Membrana caveolă conține caveolin-1 și cavină și este bogată în colesterol. Orificiile (stomatele) caveolelor sunt de obicei închise de diafragme subțiri cu grosimea de 6-8 nm, conținând proteina veziculelor plasmalemale-1 (PV1 ) . [40] [41] Pe lângă funcția de transport transcelular, caveolele au o mare importanță în metabolismul colesterolului , în generarea de semnale intracelulare (de exemplu, ca răspuns la stresul de forfecare și VEGF) și în sinteza oxidului nitric (NO) .
Deși se crede că caveolele sunt cel mai important sistem de transport pentru macromolecule, grupurile de sute de vezicule pozitive caveolin-1 mari cu un diametru cuprins între 80 nm și 140 nm sunt prezente în venulele post-capilare, denumite VVO. Ca și în cazul caveolelor, veziculele VVO sunt conectate atât între ele, cât și la membrana plasmatică prin orificii care pot fi deschise sau închise prin diafragme. Se crede că VVO este constituit din fuziunea caveolelor. VVO traversează complet citoplasma celulei endoteliale de la suprafața luminală la cea bazală, formând canale transcelulare, dar se poate deschide și în fisurile intercelulare. [42]
Via Paracellulare
Calea paracelulară implică fisuri interendoteliale: aceste spații au o lățime de aproximativ 15-20 nm și o lungime de 0,15-1,5 mm și sunt traversate și îngustate de joncțiunile ocluzive ( joncțiuni strânse ), corespunzătoare celor cum ar fi intercelularul spațiul este redus la doar 4 nm în diametru. Cu toate acestea, cu excepția barierei hematoencefalice, joncțiunile ocluzive ale celulelor endoteliale nu formează o bandă continuă de-a lungul întregului contur al celulei (ca în epitelii), ci sunt organizate în segmente discontinue și nealiniate, adică dispuse la diferite înălțimi pe peretele lateral al celulelor endoteliale. [43] [44] Din această dispoziție rezultă că discontinuitățile ar forma căi întortocheate și prea largi pentru a constitui un filtru eficient pentru difuzia substanțelor dizolvate. Într-o reconstrucție tridimensională, discontinuităților li s-a atribuit o amplitudine de aproximativ 22 nm și o lungime de 40-90 nm. [45] Funcția de filtru poros ar fi, prin urmare, îndeplinită de glicoproteinele de membrană care ocupă fantele interendoteliale („teoria matricei de fibre” de Curry și Michel). [45] Prin urmare, bariera de difuzie este identificată în prezent în glicocalix care acoperă atât suprafața endotelială, cât și fisurile intercelulare („modelul glicocalixului-fisurilor”): porozitatea glicocalixului ar reprezenta astfel „porii mici” ai fiziologilor. [46] ] permite să explice de ce îndepărtarea proteinelor sau a albuminei singure (care participă la formarea stratului endotelial superficial, ESL) din mediu crește permeabilitatea barierei endoteliale. [47]
Controlul tonului navei
Il tono vasale è controllato a livello sistemico dal sistema nervoso autonomo , da ormoni , da sostanze vasoattive plasmatiche ea livello soprattutto locale (ma non solo) da mediatori tissutali e endoteliali. [31]
La secrezione endoteliale è modulata dalle forze emodinamiche e da una varietà di segnali chimici. Le cellule endoteliali possiedono, infatti, un complesso apparato recettoriale in grado di essere attivato dalle variazioni di flusso ( shear stress ) e da un ampio spettro di sostanze (ormoni, mediatori dell' infiammazione , endotossine batteriche , LDL ossidate, ecc.). Il controllo della muscolatura vasale viene esercitato dall'endotelio attraverso tre modalità: attività enzimatica su substrati plasmatici (es. enzima convertitore dell'angiotensina ); secrezione paracrina (locale) di mediatori vasoattivi; accoppiamenti diretti con le cellule muscolari lisce tramite le MEJ.
In generale, i mediatori vasodilatatori possiedono anche azione anti-proliferativa, anti-trombotica e anti-aterogena, mentre le sostanze vasocostrittrici hanno azioni opposte. [48] In condizioni fisiologiche prevale la produzione di sostanze vasodilatatrici. [49] La produzione dei composti vasoattivi endoteliali varia con l'età e con le condizionioni patologiche, nelle quali l'eccessiva produzione di radicali liberi sposta l'equilibrio verso la prevalenza delle sostanze vasocostrittrici/pro-aggreganti piastriniche.
Sulla base della natura chimica i mediatori vasoattivi endoteliali possono essere classificati in: composti lipidici (eicosanoidi; fattore attivante le piastrine, PAF), peptidi (endotelina-1, ET-1; angiotensina II, ATII; fattore di crescita di derivazione piastrinica, PDGF; peptide natriuretico, NP), di-nucleotidi (uridin-adenosin-tetrafosfato, UP 4 A), composti inorganici (ossido di azoto, NO; radicali liberi dell'ossigeno, ROS; acido sulfidrico, H 2 S; ioni K + ).
Dalla ossidazione dell'aminoacido L- arginina in L-citrullina, ad opera delle nitrossido-sintetasi ( NOS ), deriva l' ossido nitrico (NO). Questo mediatore attiva, nelle cellule muscolari lisce, l'enzima guanil-ciclasi che genera il secondo messaggero GMPc , in grado di indurre rilasciamento della muscolatura. NO è prodotto costitutivamente dalla nitrossido-sintetasi endoteliale (eNOS); nell'endotelio è presente anche la nitrossido-sintetasi inducibile (iNOS).
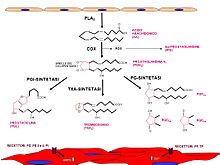
Derivati dell'acido arachidonico. L' acido arachidonico (acido grasso polinsaturo a 20 atomi di carbonio, C20:4), liberato dai glicerofosfolipidi di membrana per azione della fosfolipasi A 2 , è una delle più importanti fonti di metaboliti vasoattivi. Da esso derivano numerosi eicosanoidi (dal greco eikosi , venti, e eidos , forma): prostanoidi , leucotrieni e lipossine , che sono ormoni locali (o autacoidi, dal greco autòs , se stesso, e àkos , rimedio). Questo acido grasso può infatti essere metabolizzato dalle ciclossigenasi (COX1 e 2), dalle lipossigenasi (LOX) e dalla epossigenasi (citocromo P450 monossigenasi, CYP450).
Dalle COX endoteliali derivano sei prostanoidi, ovvero prostaglandine (PG) e trombossano (Tx): [50] PGI 2 ( prostaciclina ) e PGD 2 con attività vasodilatatoria e anti-aggregante piastrinica; PGH 2 , PGF 2 α e TxA 2 ad azione vasocostrittrice e pro-aggregante; PGE 2 ad azione variabile a seconda della concentrazione e del letto vasale. Questi mediatori esercitano le loro azioni interagendo con i recettori di membrana DP, EP, FP, IP e TP (recettore TxA 2 ) accoppiati alle proteine G : DP, EP 2 , EP 4 e IP aumentano l' AMP ciclico (AMPc) mediante le proteine Gs; TP, EP 1 e FP innalzano il calcio intracellulare per mezzo delle Gq; EP 3 riduce la concentrazione di AMPc attraverso le Gi. Per la loro capacità di ossidare substrati, le COX sono anche fonte di radicali liberi dell'ossigeno (anioni superossido, O 2 - ).
Dall'epossigenasi derivano gli acidi epossi-eicosa-trienoici (EET) e di-idrossi-eicosatrienoici (DHET) ad azione vasodilatatrice; azione analoga hanno gli acidi idrossi-eicosa-tetraenoici (HETE) derivati dalla 15-lipossigenasi endoteliale (15-LOX-1). [51] HETE e EET attivano i canali del K + calcio-dipendenti delle cellule muscolari lisce, provocando iperpolarizzazione della muscolatura e rilasciamento vasale.
Mediatori vasodilatatori
In condizioni fisiologiche prevale la liberazione endoteliale di mediatori vasodilatatori: NO ( ossido nitrico ), PGI 2 (prostaciclina) e EDHF ( endothelium-derived hyperpolarization factor ). Il loro ruolo è stato dimostrato negli uomini e negli animali in vivo ed ex vivo in arterie isolate, sia in condizioni basali che dopo stimolazione con agonisti (es. acetilcolina , bradichinina ) o esposizione al flusso.
La vasodilatazione endotelio-dipendente indotta dai diversi agonisti varia a seconda della specie animale: l'acetilcolina causa rilasciamento endotelio-dipendente delle arterie sistemiche di tutte le specie esaminate (variazioni si hanno invece nel comportamento delle arterie polmonari e cerebrali e delle vene); [N 1] la bradichinina provoca rilasciamento delle arterie umane e canine, ma non di quelle di coniglio né di gatto; l'istamina determina vasodilatazione delle arterie di ratto, ma non di coniglio. [54]
L'aumento delle resistenze vasali totali e della pressione arteriosa media che si ottiene, in soggetti sani, dalla somministrazione di inibitori delle COX (es. indometacina), delle NOS (es. L-NMMA) e di EDHF (es. KCl) è a favore di un ruolo fisiologico di NO, PG e EDHF nel controllo del tono vasale. [55] La produzione di questi composti è stimolata dallo shear stress e da numerosi agonisti ed è regolata in modo tale che il deficit di uno di essi venga compensato dall'iperproduzione degli altri.
EDHF è costituito da un insieme di sostanze capaci di provocare iperpolarizzazione delle cellule muscolari lisce. EDHF viene infatti definito come "il complesso di sostanze che causano la vasodilatazione che residua dopo somministrazione di inibitori di NOS e di COX e che è inibita dai bloccanti dei canali del K + o dalle alte concentrazioni extracellulari di K +" . EDHF probabilmente include derivati dell'acido arachidonico, peptidi, CO (monossido di carbonio), H 2 S (acido sulfidrico) e H 2 O 2 . [56]
Un'altra via attraverso la quale le cellule endoteliali possono causare iperpolarizzazione della muscolatura vasale è quella delle giunzioni MEJ; in questo caso è il passaggio di ioni K + direttamente dall'endotelio alla tonaca muscolare che causa iperpolarizzazione: l'iperpolarizzazione riduce l'ingresso di calcio (Ca ++ ) nelle cellule muscolari lisce attraverso i canali Ca-voltaggio dipendenti e determina vasodilatazione.
Una serie di lavori nell'uomo e negli animali hanno dimostrato che l'importanza dei singoli mediatori muta con il variare del calibro dei vasi: la vasodilatazione delle arterie elastiche e muscolari dipende principalmente da NO, mentre quella arteriolare è influenzata maggiormente da EDHF e PGI 2 . [57] [58]
1) Ossido Nitrico (NO)
L'intervento di NO nel tono vasale basale nell'uomo è dimostrato dalla constatazione che l'inibizione della sintesi di NO con analoghi dell'arginina provoca un aumento della pressione arteriosa, aumento che viene annullato dalla somministrazione di L-arginina. In uno studio in soggetti sani normotesi, l'inibitore della NOS N-monometil-L-arginina (L-NMMA) ha determinato un aumento della pressione arteriosa media di 8-15 mmHg, mentre con l'inibitore N-nitro-L-arginina-metil-estere (L-NAME) l'aumento è stato di 10-23 mmHg; all'effetto tardivo sulla pressione arteriosa sembra partecipare l'attivazione simpatica dovuta all'inibizione della NOS del sistema nervoso centrale (nNOS). [59] Allo stesso modo i ratti con deficit genetico di NOS endoteliale (eNOS -/- ) sono ipertesi. La sintesi di NO declina con l'età. [60]
La compromissione della sintesi di NO nella disfunzione endoteliale è responsabile di un eccesso di vasocostrizione con un aumento del tono vasale, nonché di una diminuzione dell'attività anti-aggregante. In presenza di stress ossidativi, gli O 2 - interagiscono con NO inattivandolo e formando perossinitrito (ONOO − ) che è a sua volta un radicale libero dell'azoto (RNS).
2) Prostaciclina (PGI 2 )
Il principale mediatore vasodilatatore derivato dalle COX nelle cellule endoteliali umane è la prostaglandina bicilcica PGI 2 (prostaciclina). La somministrazione di inibitori delle COX ( indometacina ) in volontari sani ha provocato un aumento delle resistenze vasali totali (+20%) e della pressione arteriosa media (+10 mmHg), [61] mentre l'infusione di acido acetilsalicilico nell'arteria brachiale ha determinato una riduzione del 32% del flusso sanguigno dell'avambraccio. [62] L'infusione di PGI 2 negli animali anestetizzati (cane, ratto, coniglio) causa ipotensione, sia che la somministrazione venga fatta per via endovenosa che endoarteriosa, poiché la PGI 2 , a differenza delle altre prostaglandine, non viene metabolizzata nel polmone; la sua perfusione in cuori isolati induce dilatazione delle arterie coronarie. La PGI 2 è la più abbondante prostaglandina prodotta dall'endotelio: la sua concentrazione è 10-100 superiore a quella delle altre prostaglandine endoteliali, ma declina con l'età. Si tratta di una delle più potenti sostanze vasodilatatrici dell'organismo, con un effetto circa 8 volte maggiore della PGE 2 , tanto che la prostaciclina sintetica (epoprostenol) ei suoi analoghi (iloprost e treprostinil) sono impiegati per il trattamento dell'ipertensione polmonare. Sebbene la PGI 2 a concentrazioni fisiologiche abbia azione vasodilatatrice, ad alte concentrazioni essa acquista modeste proprietà vasocostrittrici; il diverso comportamento è in relazione ai differenti recettori muscolari attivati: IP nel primo caso, TP nel secondo. La stimolazione del recettore IP causa l'attivazione della proteina Gs e l'aumento di AMPc nelle cellule muscolari lisce, con conseguente apertura dei canali K + ATP-dipendenti e iperpolarizzazione. La delezione del gene IP nei topi si accompagna a ipertensione e diminuzione dell'attività antiaggregante; al contrario, i topi con deficit genetico del recettore TP sono normotesi, ma hanno tendenza al sanguinamento.
La PGI 2 è sintetizzata all'azione sequenziale delle COX e della prostaciclina-sintetasi (PGIS). Sia la COX1 che la COX2 sono espresse nell'endotelio: la COX1 (COX costitutiva) è espressa costitutivamente ed è prevalente in condizioni basali; [63] [64] l'espressione della COX2 (COX inducibile) è incrementata da shear stress , citochine infiammatorie, mediatori piastrinici, endotossine batteriche, LDL ossidate, trombina e ipossia. Sebbene gli studi farmacologici con inibitori della COX2 ( Coxib ) e gli studi sperimentali su topi con deficit del gene Cox2 lascino supporre che la produzione endoteliale di PGI 2 sia dovuta principalmente all'attività della COX2, rimangono dubbi su quale sia la COX maggiormente responsabile della formazione della PGI 2 [65] [66] [67] . La PGIS è estremamente sensibile all'inattivazione da parte del perossinitrito: situazioni di stress ossidativo determinano la deviazione della sintesi dei prostanoidi verso composti vasocostrittori/pro-aggreganti; contemporaneamente i radicali liberi aumentano la stabilità e il numero dei recettori TP. [68] In queste situazioni, l'induzione della COX2 tenta di compensare il deficit di PGI 2.
Mediatori vasocostrittori
Gli studi sperimentali su preparati animali hanno osservato che, in condizioni fisiologiche, alcuni vasi (es. arterie e vene polmonari) rispondono alla stimolazione con agonisti (es. acetilcolina, acido arachidonico) con la sintesi si sostanze vasocostrittrici e che la vasocostrizione è inibita dalla rimozione dell'endotelio. [69] Nell'uomo i mediatori vasocostrittori hanno importanza soprattutto nell'invecchiamento e in condizioni patologiche (es. ipertensione , diabete ) [70] (vedi Trombossani - Fisiopatologia). [N 2] Nelle indagini sperimentali i mediatori responsabili della vasocostrizione variano in base alla specie animale, al tipo di distretto vasale esaminato e allo stimolo utilizzato. Sono però frequentemente in causa prodotti delle COX, poiché la vasocostrizione viene molto spesso attenuata o prevenuta dagli inibitori dalle COX (es. indometacina). [73] [74]
Le principali sostanze vasocostrittrici comprendono: prostanoidi (TXA 2 e PGH 2 ) e altri derivati fosfolipidici ( fattore attivante le piastrine , PAF; isoprostani, iPG), peptidi ( endotelina 1 , ET-1; angiotensina II, ATII; fattore di crescita derivato dalle piastrine , PDGF), ROS (O - 2 e H 2 O 2 ) e di-nucleotidi (uridin-adenosin-tetrafosfato, UP 4 A). Sebbene gli endoperossidi ciclici (PGH 2 ) siano composti instabili a breve emivita, essi tuttavia possono attivare il recettore TP e provocare vasocostrizione. ATII agisce sia come ormone sistemico che come autacoide locale. Gli isoprostani sono isomeri delle prostaglandine generati dalla perossidazione non enzimatica degli acidi grassi polinsaturi (es. acido arachidonico) presenti nei fosfolipidi di membrana. I ROS si formano durante la sintesi di PGH 2 da parte delle COX, nonché per azione di altri enzimi cellulari (es. NOS , NADPH ossidasi , xantina ossidasi ); una volta prodotti, essi, e in particolare H 2 O 2 , sono in grado di indurre contrazione della muscolatura liscia vasale per azione diretta e indiretta (disattivazione di NO e stimolazione della sintesi di prostanoidi vasocostrittori). [N 3]
Funzioni emostatiche
Le cellule endoteliali intervengono nella regolazione dell' emostasi , producendo, a seconda delle circostanze, attivatori o inibitori delle piastrine , della coagulazione e della fibrinolisi . In condizioni fisiologiche l'endotelio assicura ai vasi un rivestimento non trombogeno che impedisce sia l'attivazione delle piastrine che delle proteine del sistema della coagulazione. La presenza di endotelio evita, inoltre, il contatto del sangue con le fibre collagene e la matrice subendoteliale, in particolare con il fattore di Von Willebrand (vWF) e con il fattore tissutale (TF), [80] una glicoproteina espressa sulle cellule della parete vasale. Le fibre collagene e vWF provocano aggregazione piastrinica, mentre l'interazione di TF con il fattore plasmatico VII forma un complesso che attiva la via estrinseca della coagulazione. [81]
Proteine anti-trombogene sono esposte sulla membrana delle cellule endoteliali (trombomodulina, inibitore della via del fattore tissutale o TFPI, eparansolfato-proteoglicani e CD39) e sostanze solubili sono liberate dall'endotelio (NO, PGI 2 , proteina C, proteina S, attivatore tissutale del plasminogeno o tPA e urochinasi o u-PA). La trombomodulina [82] , il TFPI, [83] gli eparansolfati-proteoglicani e la proteina C [84] [85] inibiscono la cascata della coagulazione, mentre NO, PGI 2 e CD39 [86] possiedono azione antiaggregante piastrinica. NO e PGI 2 hanno un'azione antiaggregante diretta; CD39/ENTPD1 (CD39/ ecto-nucleoside triphosphate diphosphohydrolase 1 ) è una ADPasi che degrada l'ADP, uno dei principali attivatori delle piastrine. La trombomodulina si lega alla trombina neutralizzandola e, in più, il complesso trombomodulina-trombina attiva la proteina C. La proteina C attivata si lega alla proteina S e il complesso neoformato acquista proprietà anticoagulanti. L'eparansolfato attiva l'antitrombina III che inibisce la trombina e altri fattori della coagulazione. Sia t-PA che u-PA convertono il plasminogeno in plasmina, enzima capace di degradare la fibrina del coagulo.
Al contrario l'attivazione delle cellule endoteliali si accompagna all'acquisizione di proprietà protrombotiche, come la secrezione del vWF multimerico contenuto nei corpi WP, l'esposizione del TF e la produzione dell'inibitore dell'attivatore del plasminogeno (PAI-1).
Funzioni endocrino-metaboliche
Metabolismo delle lipoproteine plasmatiche
L'intervento dell'endotelio sul metabolismo delle lipoproteine plasmatiche include il trasferimento delle LDL nel subendotelio e l'attività delle triglicerido-lipasi: lipoproteinlipasi (LPL), lipasi endoteliale (EL) e lipasi epatica (HL) (vedi Lipoproteina - Metabolismo delle lipoproteine plasmatiche). [87] Queste lipasi sono enzimi chiave del metabolismo delle lipoproteine. La loro azione consiste nella idrolisi (scissione per inserimento di una molecola di acqua nel substrato) dei trigliceridi contenuti nei chilomicroni , sintetizzati dalla mucosa intestinale durante il pasto, nelle lipoproteine a densità molto bassa ( VLDL ), sintetizzate dal fegato, e nelle lipoproteine a densità intermedia (IDL). Tutte queste proteine hanno la funzione di veicolare nel sangue i grassi, principalmente i trigliceridi , che sono insolubili in acqua. Gli acidi grassi liberati dalle lipoproteine plasmatiche possono così attraversare l'endotelio e raggiungere i tessuti.
La LPL è presente sia nei capillari che nelle arterie; è sintetizzata dalle cellule dei tessuti, le quali la secernono negli spazi interstiziali, da dove viene endocitata dalle cellule endoteliali e trasportata sulla loro superficie luminale. [88] [89] Una volta esposta sulla superficie endoteliale, essa si ancora agli eparansolfato-proteoglicani di membrana. [90] La LPL lega le liporoteine plasmatiche e promuove l'idolisi dei loro trigliceridi, determinando la trasformazione dei chilomicroni e delle VLDL nelle particelle rimanenti (IDL), che hanno un più basso contenuto lipidico. In questo processo interviene anche la proteina di membrana GPIHBP1 ( glycosylphosphatidylinositol HDL binding protein 1 ), che fornisce la piattaforma sulla quale vengono in contatto la lipoproteinlipasi e le lipoproteine plasmatiche. [91] La LPL che si trova a livello interstiziale concorre alla patogenesi dell'aterosclerosi (vedi Patobiologia dell'aterosclerosi ).
La HL è sintetizzata dagli epatociti ed è esposta sull'endotelio dei sinusoidi epatici, dove svolge azione sovrapponibile alla precedente, con la differenza che i suoi substrati sono i chilomicroni rimanenti, le IDL e le HDL. [92] L'EL è l'unico enzima della famiglia ad essere sintetizzato dalle cellule endoteliali; la sua attività si rivolge soprattutto ai fosfolipidi delle lipoproteine plasmatiche con liberazione degli acidi grassi. [93]
Metabolismo dell'angiotensina
L'endotelio ha un ruolo determinante nella produzione dell'ormone angiotensina II (ATII), che rappresenta uno dei più potenti agenti che aumentano la pressione arteriosa: l'ATII è uno dei più potenti vasocostrittori e una delle più potenti sostanze sodio-ritentrici (sostanze che inducono il riassorbimento renale di sodio). Sulla superficie endoteliale è esposto l'enzima convertitore dell'angiotensina (ACE), enzima coinvolto nella regolazione della pressione arteriosa. [94] In particolare l'ACE catalizza la rimozione per idrolisi del dipeptide terminale dell'angiotensina I, fisiologicamente inattiva, formando l'octapeptide angiotensina II, biologicamente attivo. La conversione si verifica per la gran parte quando il sangue passa attraverso i polmoni, ma in grado minore avviene anche nelle altre parti dell'organismo. È stato dimostrato che circa il 100% dei capillari polmonari esprime l'ACE contro il 10-15% di quelli della circolazione sistemica. [95] L'ACE idrolizza anche la bradichinina, un peptide vasodilatatore, inattivandola.
L'ACE è una singola molecola polipeptidica inserita nella membrana plasmatica luminale delle cellule endoteliali. L'enzima possiede pertanto un dominio extracellulare, in cui risiede l'attività enzimatica, un dominio transmembranaceo e uno intracellulare, citoplasmatico. Un altro enzima di membrana, l'ACE secretasi, è in grado di scindere il dominio extracellulare dell'ACE, liberando così l'enzima in circolo.
Note
- ^ MH Ross e W. Pawlina, Tissues: concept and classification , in Histology , 6ª ed., Philadelphia, Lippincott - Williams & Wilkins, 2011, p. 102, ISBN 978-0-7817-7200-6 .
- ^ Atlante di Citologia ed Istologia - Tessuto Connettivo , su www.atlanteistologia.unito.it . URL consultato il 16 gennaio 2016 (archiviato dall' url originale il 9 maggio 2016) .
- ^ Definizione su Treccani.it , su treccani.it . URL consultato il 15 giugno 2012 .
- ^ MA Creager, J. Loscalzo e VJ Dazau, Vascular medicine , Philadelphia, Saunders-Elsevier, 2006, p. 1, ISBN 978-0-7216-0284-4 .
- ^ AR Pries, Normal endothelium , in Handbook of experimental pharmacology , vol. 176, 2006.
- ^ G. Favero, Endothelium and Its Alterations in Cardiovascular Diseases , in BioMed Res. Intern. , 2014, ID 801896.
- ^ PB Persson, The multiple functions of the endothelium , in Acta Physiol. , vol. 213, 2015, pp. 747-749.
- ^ A. Ludwig, Architecture of the caveolar coat complex , in J. Cell Sci. , vol. 129, 2016, pp. 3077-3083.
- ^ a b W. Aird, Phenotypic Heterogeneity of the Endothelium , in Circ. Res. , vol. 100, 2007, pp. 158-173.
- ^ SA Predescu, Molecular determinants of endothelial transcytosis and their role in endothelial permeability , in Am. J. Physiol. , vol. 293, 2007, pp. L823-L842.
- ^ KM Valentijn, Functional architecture of Weibel-Palade bodies , in Blood , vol. 117, 2011, pp. 5033-5043.
- ^ NG dela Paz, Arterial versus venous endothelial cells , in Cell Tissue Res. , vol. 335, 2009, pp. 5-16.
- ^ G. Sowa, Caveolae, Caveolins, Cavins, and Endothelial Cell Function: New Insights , in Front Physiol. , vol. 2, 2011, p. 120.
- ^ BF Becker, Therapeutic strategies targeting the endothelial glycocalyx: acute deficits, but great potential ( PDF ), in Cardiovasc. Res. , vol. 87, 2010, pp. 300-310.
- ^ MR Morgan, Synergistic control of cell adhesion by integrins and syndecans , in Nat. Rev. Mol. Cell Biol. , vol. 8, 2007, pp. 957-969.
- ^ X. Xian, Syndecans as receptors and organizers of the extracellular matrix ( PDF ), in Cell Tissue Res. , vol. 339, 2010, pp. 31-46.
- ^ A. Huttenlocher, Integrins in Cell Migration , in Cold Spring Harb. Perspect. Biol. , vol. 3, 2011, p. 6.
- ^ G. Gabbiani, Organization of actin cytoskeleton in normal and regenerating arterial endothelial cells , in Proc. Natl. Acad. Sci. USA , vol. 80, 83, pp. 2361-2364.
- ^ MD Shasby, Role of endothelial cell cytoskeleton in control of endothelial permeability , in Circ. Res. , vol. 51, 1982, pp. 657-661.
- ^ PL Walpola, Monocyte adhesion and changes in endothelial cell number, morphology, and F-actin distribution elicited by low shear stress in vivo , in Am. J. Pathol. , vol. 142, 1993, pp. 1392-1400.
- ^ C. Iomini, Primary cilia of human endothelial cells disassemble under laminar shear stress , in J. Cell Biol. , vol. 164, 2004, pp. 811-817.
- ^ MD Haust, Endothelial cilia in human aortic atherosclerotic lesions , in Virchows Archiv. , vol. 410, 1987, pp. 317-326.
- ^ VB Bystrevskaya, An ultrastructural study of centriolar complexes in adult and embryonic human aortic endothelial cells , in Tissue and Cell. , vol. 20, 1988, pp. 493-503.
- ^ SM Nauli, The Mechanosensory Role of Primary Cilia in Vascular Hypertension , in Int. J. Vasc. Med. , 2011, 376281.
- ^ TJ Jones, Primary cilia regulates the directional migration and barrier integrity of endothelial cells through the modulation of hsp27 dependent actin cytoskeletal organization , in J. Cell Physiol. , vol. 227, 2012, pp. 70-76.
- ^ JE Gabriels, Connexin43 Is Highly Localized to Sites of Disturbed Flow in Rat Aortic Endothelium but Connexin37 and Connexin40 Are More Uniformly Distributed , in Circ. Res. , vol. 83, 1998, pp. 636-643.
- ^ M. Billaud, Regulation of Cellular Communication by Signaling Microdomains in the Blood Vessel Wall , in Pharmacol. Rev. , vol. 66, 2014, pp. 513-569.
- ^ XF Figueroa, Vascular gap junctions in hypertension , in Hypertension , vol. 48, 2006, pp. 804-811.
- ^ a b CC Michel, Microvascular Permeability , in Physiol. Rev. , vol. 79, 1999, pp. 703-761.
- ^ RF Tuma, WN Duran e K. Ley, Handbook of Physiology. Microcirculation , USA, Academic Press - Elsevier, 2008, pp. 37-55, ISBN 978-0-12-374530-9 .
- ^ a b AC Guyton e JE Hall, GUYTON AND HALL TEXTBOOK OF MEDICAL PHYSIOLOGY , 13ª ed., Philadelphia, Elsevier, 2016, pp. 189-192, ISBN 978-1-4557-7005-2 .
- ^ PG Frank, Caveolin, Caveolae, and Endothelial Cell Function , in Arterioscl. Thromb. Vasc. Biol. , vol. 23, 2003, pp. 1161-1168.
- ^ L. Claesson-Welsh., Vascular permeability--the essentials , in Ups J. Med. Sci. , vol. 120, 2015, pp. 135-143.
- ^ a b PL Tuma, Transcytosis: Crossing Cellular Barriers , in Physiol. Rev. , vol. 83, 2003, pp. 871-932.
- ^ PM Azizi, Clathrin-dependent entry and vesicle-mediated exocytosis define insulin transcytosis across microvascular endothelial cells , in Mol. Biol. Cell. , vol. 26, 2015, pp. 740-750.
- ^ VE Simionescu, Visualization of the binding, endocytosis, and transcytosis of low-density lipoprotein in the arterial endothelium in situ , in J. Cell. Biol. , vol. 96, 1983, pp. 1677-1689.
- ^ SM Armstrong, A novel assay uncovers an unexpected role for SR-BI in LDL transcytosis , in Cardiovasc. Res. , vol. 108, 2015, pp. 268-277.
- ^ GM Dallinga-Thie, Triglyceride-Rich Lipoproteins and Remnants: Targets for Therapy? , in Curr. Cardiol. Rep. , vol. 18, 2016, p. 67.
- ^ SA Predescu, Molecular determinants of endothelial transcytosis and their role in endothelial permeability , in Am. J. Physiol. , vol. 293, 2007, pp. L823–L842.
- ^ JP Gratton, Caveolae and Caveolins in the Cardiovascular System , in Circ. Res , vol. 94, 2004, pp. 1408-1417.
- ^ J. Nagy, Vascular Hyperpermeability, Angiogenesis, and Stroma Generation , in Cold Spring Harbor Persp. in Med. , vol. 2, 2012, p. a006544.
- ^ D. Feng, The vesiculo-vacuolar organelle (VVO). A new endothelial cell permeability organelle , in J Histochem Cytochem , vol. 49, 2001, pp. 419-432. URL consultato il 16 settembre 2016 (archiviato dall' url originale il 26 novembre 2015) .
- ^ SL Wissig, The permeability of muscle capillaries to microperoxidase. , in J. Cell. Biol. , vol. 76, 1978, pp. 341-359.
- ^ M. Bundgaard, The three-dimensional organization of tight junctions in a capillary endothelium revealed by serial-section electron microscopy ( abstract ), in J. Ultrastruct. Res. , vol. 88, 1984, pp. 1-17.
- ^ a b JA Firth, Endothelial barriers: from hypothetical pores to membrane proteins , in J. Anat. , vol. 200, 2002, pp. 541-548.
- ^ J. Rodney Levick, Microvascular fluid exchange and the revised Starling principle , in Cardiovasc. Res. , vol. 87, 2010, pp. 198-210.
- ^ CC Michel, Capillary permeability and how it may change ( PDF ), in J. Physiol. , vol. 404, 1988, pp. 1-29.
- ^ IC Villar, Novel aspects of endothelium-dependent regulation of vascular tone , in Kidney Intern. , vol. 70, 2006, pp. 840-853.
- ^ TF Luscher, Imbalance of endothelium-derived relaxing and contracting factors. A new concept in hypertension? , in Am. J. Hypertens. , vol. 3, 1990, pp. 317-330, PMID 2189444 .
- ^ M. Feletou, Endothelium-mediated control of vascular tone: COX-1 and COX-2 products , in Br. J. Pharmacol. , vol. 164, 2011, pp. 894-912.
- ^ AD Dobrian, Functional and pathological roles of the 12- and 15-lipoxygenases , in Prog. Lipid Res. , vol. 50, 2011, pp. 115-131.
- ^ Luscher TF, Diederich D., Siebenmann R., Lehmann K., Stulz P., Von Seggesser L., Yang ZH, Turina M., Gradel E., Weber E., Buhler FR, Difference between endothelium-dependent relaxation in arterial and in venous coronary bypass grafts , in N. Engl. J. Med. , vol. 319, 1988, pp. 462-467.
- ^ Arner M., Hogestatt ED, Endothelium-dependent relaxation and effects of prostacyclin, endothelin and platelet-activating factor in human hand veins and arteries , in Acta Physiol. Scand. , vol. 142, 1991, pp. 165-172.
- ^ H. Jornvall, Nobel lectures in physiology or medicine 1996-2000 , Singapore, World Scientific, 2003, p. 157, ISBN 981-238-005-1 .
- ^ WB Campbell, Arachidonic acid metabolites as endothelium-derived hyperpolarizing factors , in Hypertension , vol. 49, 2007, pp. 590-596.
- ^ M. Feletou, EDHF: an update , in Clin. Sci. , vol. 117, 2009, pp. 139-155.
- ^ RP Brandes, An endothelium-derived hyperpolarizing factor distinct from NO and prostacyclin is a major endothelium-dependent vasodilator in resistance vessels of wild-type and endothelial NO synthase knockout mice ( PDF ), in PNAS , vol. 97, 2000, pp. 9747-9752.
- ^ L. Urakami-Harasawa, Importance of Endothelium-derived Hyperpolarizing Factor in Human Arteries ( PDF ), in J. Clin. Invest. , vol. 100, 1997, pp. 2793-2799.
- ^ M. Sander, A large blood pressure-raising effect of nitric oxide synthase inhibition in humans , in Hypertension , vol. 33, 1999, pp. 937-942.
- ^ M. Barton, Anatomic heterogeneity of vascular aging: role of nitric oxide and endothelin , in Hypertension , vol. 30, 1997, pp. 817-824.
- ^ A. Wennmalm, Influence of indomethacin on the systemic and pulmonary vascular resistance in man ( PDF ), in Clin. Sci. Mol. Med. , vol. 54, 1978, pp. 141-145.
- ^ SJ Duffy, Continuous release of vasodilator prostanoids contributes to regulation of resting forearm blood flow in humans , in Am. J. Physiol. , vol. 274, 1998, pp. H1174–H1183 (archiviato dall' url originale il 2 dicembre 2016) .
- ^ Hao Qian, Aging-Shifted Prostaglandin Profile in Endothelium as a Factor in Cardiovascular Disorders , in J. Aging Res. , 2012, 2012:121390.
- ^ DW Kawka, Double-label expression studies of prostacyclin synthase, thromboxane synthase and COX isoforms in normal aortic endothelium , in Biochim. Biophys. Acta , vol. 1771, 2007, pp. 45-54.
- ^ M. Feletou, Endothelium-mediated control of vascular tone: COX-1 and COX-2 products , in Br. J. Pharm. , vol. 164, 2011, pp. 894-912.
- ^ NS Kirkby, Cyclooxygenase-1, not cyclooxygenase-2, is responsible for physiological production of prostacyclin in the cardiovascular system , in Proc. Natl. Acad. Sci. USA , vol. 109, 2012, pp. 17597-17602.
- ^ NS Kirkby, Systematic study of constitutive cyclooxygenase-2 expression: Role of NF-κB and NFAT transcriptional pathways , in Proc. Natl. Acad. Sci. USA , vol. 113, 2016, pp. 434-439.
- ^ RA Cohen, TP receptors and oxidative stress: hand in hand from endothelial dysfunction to atherosclerosis , in Adv. Pharmacol. , vol. 60, 2010, pp. 85-106.
- ^ PM Vanhoutte, Endothelium-dependent contractions in hypertension , in Br. J. Pharmacol. , vol. 144, 2005, pp. 449-458.
- ^ D. Versari, Endothelium-dependent contractions and endothelial dysfunction in human hypertension , in Br. J. Pharmacol. , vol. 157, 2009, pp. 527-536.
- ^ Taddei S, Virdis A, Mattei P, Salvetti A., Vasodilation to acetylcholine in primary and secondary forms of human hypertension , in Hypertension , vol. 21, 1993, pp. 929-933.
- ^ Taddei S, Virdis A, Mattei P, Ghiadoni L, Sudano I, Salvetti A., Defective L-arginine-nitric oxide pathway in offspring of essential hypertensive patients , in Circulation , vol. 94, 1996, pp. 1298-1303.
- ^ PM Vanhoutte, The endothelium. Relaxing and contracting factors , Clifton, Humana Press Inc., 1988, pp. 27-38, ISBN 978-1-4612-8939-5 .
- ^ PM Vanhoutte, Cardiovascular pharmacology: Endothelial control , Elsevier, 2010, pp. 61 -83, ISBN 978-0-12-385061-4 .
- ^ Roveri A et al. , Effect of hydrogen peroxide on calcium homeostasis in smooth muscle cells , in Arch. Biochem. Biophys. , vol. 297, 1992, pp. 265-270.
- ^ Yang ZW et al , Hydrogen peroxide induces contraction and raises [Ca 2+ ] i in canine cerebral arterial smooth muscle: Participation of cellular signalling pathways , in Naunyn Schmiedebergs Arch Pharmacol. , vol. 360, 1999, pp. 646-653.
- ^ Henry Jay Forman, Enrique Cadenas, Oxidative stress and signal transduction , in Springer Science and Business Media Dordrecht. , 1997, pp. 77-107.
- ^ Francisco R. González‐Pacheco et al , Mechanism of vascular smooth muscle cells activation by hydrogen peroxide: role of phospholipase C gamma , in Nephrol. Dial. Transplant. , vol. 17, 2002, pp. 392-398.
- ^ Kenji Asai et al , Human group IVC phospholipase A 2 (cPLA 2gamma ): roles in the membrane remodeling and attivation induced by oxidative stress , in J. Biol. Chem. , vol. 278, 2003, pp. 8809-8814.
- ^ N. Mackman, The many faces of tissue factor , in J. Thromb. Haemost. , 7(Suppl.1), 2009, pp. 136-139.
- ^ N. Mackman, Role of the Extrinsic Pathway of Blood Coagulation in Hemostasis and Thrombosis , in Arteriosc. Thromb. Vasc. Biol. , vol. 27, 2007, pp. 1687-1693.
- ^ T. Okamoto, Thrombomodulin: A Bifunctional Modulator of Inflammation and Coagulation in Sepsis , in Crit. Care Res. Pract. , vol. 2012, 2012, p. 614545.
- ^ JP Wood, Biology of tissue factor pathway inhibitor , in Blood , vol. 123, 2014, pp. 2934-2943.
- ^ B. Dahlbäck, Regulation of blood coagulation by the protein C anticoagulant pathway , in Arterioscl. Thromb. Vasc. Biol. , vol. 25, 2005, pp. 1311-1320.
- ^ EAM Bouwens, Mechanisms of anticoagulant and cytoprotective actions of the protein C pathway , in J. Thromb. Haem. , 11(Suppl.1), 2013, pp. 242-253.
- ^ AJ Marcus, Heterologous cell±cell interactions: thromboregulation, cerebroprotection and cardioprotection by CD39 (NTPDase-1) , in J. Thromb. Haem. , vol. 1, 2003, pp. 2497-2509.
- ^ H. Wang, Lipoprotein lipase: from gene to obesity , in Am. J. Physiol. , vol. 297, 2009, pp. E271-E288.
- ^ IJ Goldberg, Lipoprotein lipase. physiology, biochemistry, and molecular biology , in Frontiers in Bioscience , vol. 6, 2001, pp. 388-405.
- ^ SG Young, GPIHBP1, an endothelial cell transporter for lipoprotein lipase , in J. Lipid Res. , vol. 52, 2011, pp. 1869-1884.
- ^ H. Wang, Lipoprotein lipase: from gene to obesity , in Am. J. Physiol. , vol. 297, 2009, pp. E271-E288.
- ^ AP Beigneux, GPIHBP1, a GPI-anchored protein required for the lipolytic processing of triglyceride-rich lipoproteins ( PDF ), in J. Lipid Res. , vol. 50, 2009, pp. S57–S62.
- ^ A. Zambon, Relevance of hepatic lipase to the metabolism of triacylglycerol-rich lipoproteins ( PDF ), in Biochem. Soc. Trans. , vol. 31, 2003, pp. 1070-1074.
- ^ ME Paradis, Endothelial lipase: Its role in cardiovascular disease , in Can. J. Cardiol. , 22(Suppl B), 2006, pp. 31B–34B.
- ^ KE Bernstein, A Modern Understanding of the Traditional and Nontraditional Biological Functions of Angiotensin-Converting Enzyme ( abstract ), in Pharmacol. Rev. , vol. 65, 2013, pp. 1-46.
- ^ OV Kryukova, Tissue Specificity of Human Angiotensin I-Converting Enzyme , in PLoS One , vol. 10, 2015, p. e0143455.
Riferimenti
- ^ Risposta dei vasi sistemici umani all'acetilcolina (ACh). Negli studi in vivo o ex-vivo (by-pass coronarico, pneumectomia), ACh induce vasodilatazione endotelio-dipendente nelle arterie umane precontratte con noradrenalina, mentre la vasodilatazione è modesta o assente nelle vene. La vasodilatazione delle arterie è dovuta alla stimolazione dei recettori per ACh (M1 e M3) esposti sulla superficie endoteliale. La vasocostrizione da ACh che compare nelle arterie de-endotelizzate è conseguente all'attivazione diretta dei recettori per ACh localizzati alla superficie delle cellule muscolari lisce (M3). [52] [53]
- ^ In condizioni patologiche, come l'ipertensione essenziale, la stimolazione delle arterie con acetilcolina induce la sintesi COX-dipendente di mediatori vasocostrittori. L'infusione di acetilcolina nell'arteria brachiale di soggetti normali provoca una vasodilatazione con aumento del flusso ematico brachiale; l'aumento di flusso è in gran parte legato alla produzione di ossido nitrico (NO), dal momento che esso è fortemente attenuato dagli inibitori della nitrossido sintetasi (NOS), ma non è modificato dagli inibitori della ciclossigenasi (COX). Nei soggetti con ipertensione essenziale, l'infusione di acetilcolina è seguita da un aumento ridotto del flusso ematico brachiale. In questi soggetti gli inibitori della NOS non modificano la risposta all'acetilcolina, mentre gli inibitori della COX si accompagnano ad un aumento del flusso. Queste risposte indicano che nell'ipertensione essenziale la sintesi endoteliale di NO è compromessa, mentre dalla COX hanno origine sostanze vasocostrittrici. [71] [72]
- ^ H 2 O 2 è in grado di diffondere dalle cellule endoteliali e di penetrare nella membrana cellulare delle cellule muscolari lisce, dove ossida i fosfolipidi di membrana, specialmente gli acidi grassi polinsaturi in posizione 2, come l'acido arachidonico. L'alterazione della membrana cellulare si accompagna ad un aumento dell'ingresso di Ca +2 (con conseguente stimolazione della proteinchinasi C citoplasmatica), nonché all'attivazione dei normali meccanismi di riparazione del danno ossidativo della membrana. Questi ultimi sono rappresentati dalle fosfolipasi A 2 (PLA 2 ), che hanno lo scopo di rimuovere i fosfolipidi ossidati, sostituendoli con molecole integre. I fosfolipidi liberati dalle PLA 2 divengono substrato per la sintesi di mediatori vasocostrittori. [75] [76] [77] [78] [79]
Bibliografia generale
- ( EN ) AA.VV., Endothelial Cells in Physiology and in the Pathophysiology of Vascular Disorders , in The Journal of The American Society of Hematology , vol. 91, n. 10, American Society of Hematology, 15 giugno 2008 (archiviato dall' url originale il 21 giugno 2012) .
- N. Simionescu e M. Simionescu, Endothelial cell biology in health and disease. Plenum Press. New York. 1988. ISBN 978-1-4612-8254-9
Altri progetti
-
 Wikizionario contiene il lemma di dizionario « endotelio »
Wikizionario contiene il lemma di dizionario « endotelio » -
 Wikimedia Commons contiene immagini o altri file su endotelio
Wikimedia Commons contiene immagini o altri file su endotelio
Collegamenti esterni
- Tessuto endoteliale , su Treccani.it – Enciclopedie on line , Istituto dell'Enciclopedia Italiana .
- ( EN ) Tessuto endoteliale , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
- Tessuto endoteliale , in Treccani.it – Enciclopedie on line , Istituto dell'Enciclopedia Italiana.
| Controllo di autorità | Thesaurus BNCF 2770 · LCCN ( EN ) sh85043102 · BNF ( FR ) cb11931974r (data) |
|---|