Hipercolesterolemie
| Hipercolesterolemie | |
|---|---|
| Specialitate | endocrinologie |
| Clasificare și resurse externe (EN) | |
| ICD-9 -CM | 272,0 |
| ICD-10 | E78.0 |
| Plasă | D006937 |
| MedlinePlus | 000403 |
| eMedicină | 121424 |
Hipercolesterolemia se referă la un exces de colesterol din sânge ( colesterolemia ). Deoarece colesterolul plasmatic este prezent în diferite clase de lipoproteine circulante, se specifică de obicei dacă este vorba despre o creștere a colesterolului plasmatic total (CT) sau a colesterolului transportat doar de lipoproteinele cudensitate scăzută (LDL), denumite în mod obișnuit „colesterol rău”. Hipercolesterolemia, în special LDL, reprezintă unul dintre factorii de risc majori pentru bolile cardiovasculare pe bază aterosclerotică ( cardiopatie ischemică și accident vascular cerebral ischemic).
Colesterolemia
Colesterolul, ca toate lipidele , nu este solubil în apă , astfel încât transportul său în sânge este transportat de proteine, numite apolipoproteine (APO). Complexul format din apolipoproteine, colesterol, trigliceride și fosfolipide constituie lipoproteine , particule relativ mari care circulă în sânge pentru a transporta grăsimile către toate țesuturile .
În condiții de post (adică la efectuarea analizelor), colesterolul prezent în sânge este în cea mai mare parte (60-75%) transportat de LDL, deci doza totală de colesterol plasmatic este un indice, chiar dacă este foarte aproximativ. Colesterol LDL. Cu toate acestea, întrucât un procent bun de colesterol este transportat și de alte lipoproteine ( VLDL și HDL ), pentru o evaluare mai precisă a colesterolemiei este necesar să se măsoare nivelul colesterolului total și HDL și să se calculeze cele ale LDL. Formula Friedewald este utilizată pentru calcularea colesterolului LDL (LDL-C), cu condiția ca concentrația plasmatică a trigliceridelor (TG) să fie <400 mg / dl: C-LDL = CT - (TG / 5 + C-HDL). [1] [2] Această modalitate permite să distingem LDL (colesterolul „rău”) de HDL (colesterolul „bun”). În cazul nivelurilor de trigliceride> 400 mg / dl, este preferabil să se măsoare LDL prin metode directe.
LDL este un produs metabolic al sintezei hepatice a VLDL (ambele conțin ApoB100) și transportă colesterolul din ficat către țesuturi, unde este utilizat pentru o varietate de procese; cu toate acestea, atunci când LDL-urile sunt prezente în concentrații excesive, acumularea lor în peretele arterial promovează dezvoltarea aterosclerozei . În schimb, HDL-urile sunt responsabile pentru „transportul invers” al colesterolului, adică elimină colesterolul în exces din țesuturi și îl transportă în ficat. De aici este eliminat în lumenul intestinal parțial ca săruri biliare și parțial ca colesterol liber. Prin urmare, HDL-urile joacă o funcție de protecție asupra dezvoltării bolilor cardiovasculare. Un exces de colesterol HDL este deci un factor favorabil.
Măsurarea concentrației plasmatice a ApoB100 oferă o indicație a numărului de particule circulante VLDL și LDL.
În faza post-prandială, colesterolul, purtat de lipoproteine intestinale ( chilomicroni ), care conțin ApoB48, predomină în sânge. Dozarea lor se efectuează numai în situații particulare.
Valorile optime ale colesterolemiei
Pragul pentru diagnosticarea hipercolesterolemiei este stabilit la 240 mg / dl (6,21 mM) post pentru 12 ore. [3] Conferința de consens NIH ( National Institutes of Health ) din 1984 a definit, de fapt, ca hipercolesterolemie o concentrație plasmatică de colesterol mai mare de 240 mg / dl la subiecții cu vârsta peste 40 de ani. [4]
Cu toate acestea, dovezile colectate ulterior au arătat clar că este imposibil să se vorbească despre valorile colesterolului „normale”. În schimb, preferăm să vorbim despre valori „optime” ale colesterolului în raport cu „ riscul cardiovascular global ” al subiectului individual, adică riscul calculat luând în considerare toți factorii de risc individuali prezenți.
În prezent sunt utilizate carduri de risc cardiovascular ( risc CV), datorită cărora este posibil să se urmărească valorile colesterolului ideal pe baza procentului de risc de a dezvolta un eveniment cardiovascular în 10 ani. Principalii algoritmi utilizați pentru evaluarea riscului CV sunt Framingham Risk Score (SUA), SCORE (Europa), QRISK (Marea Britanie), ASSIGN (Scoția) și CUORE (Italia). [5] Prezența nivelurilor ridicate de HDL (> 60 mg / dl) constituie un factor de protecție, deci vorbim de un factor de risc negativ și scădem o unitate din numărul factorilor de risc ai subiectului în cauză. Subiecții care prezintă un risc de 20% sau mai mare sunt considerați echivalenți cu subiecții cu boală cardiacă ischemică, pentru care se recomandă o colesterolemie de 100 mg / dl LDL sau mai puțin și de preferință 70 mg / dl sau mai puțin.
Ca parte a studiului Framingham Heart [6], au fost elaborate tabele de calcul al riscului CV pe termen lung (30 de ani). [7]
Liniile directoare ale Programului Național de Educație pentru Colesterol (NCEP) 2001-2004 pentru grupul de tratament pentru adulți III (ATP III) au indicat următoarele valori ale colesterolului LDL drept ținte : [8]
- valorile ideale ale colesterolului la un subiect fără factori de risc cardiovascular sau cu un singur factor corespund cu 160 mg / dl de colesterol LDL sau mai puțin
- valorile ideale la o persoană cu mai mult de 1 factor de risc sunt 130 mg / dl de LDL sau mai puțin
- valorile optime pentru o persoană cu cardiopatie ischemică sau diabet sunt de 100 mg / dl de LDL sau mai puțin.
În 2013, un comitet de experți de la Colegiul American de Cardiologie / American Heart Association (ACC / AHA) a elaborat noi linii directoare care diferă în mod clar de cele ATP, deoarece indică 4 categorii de subiecți pentru care trebuie inițiat tratamentul. stabilirea valorilor țintă ale LDL ale terapiei: boală CV anterioară, diabet, subiecți cu LDL> 190 mg / dl, subiecți cu risc de 10 ani> 7,5%. [9]
În 2014, ghidurile Institutului Național pentru Excelență în Sănătate și Îngrijire (NICE) au fost publicate folosind tabele de risc QRISK2. [10]
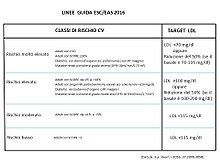
În 2019, ghidurile Societății Europene de Cardiologie / Societatea Europeană de Ateroscleroză (ESC / EAS) au fost elaborate folosind tabelele de risc pentru Estimarea riscului coronarian sistemic (SCORE). [11] Orientările ESC / EAS 2019 stabilesc următoarele obiective pentru LDL:
- Risc scăzut: LDL <116 mg / dl
- Risc moderat: LDL <100 mg / dl
- Risc ridicat: LDL <70 mg / dl
- Risc foarte mare: LDL <55 mg / dl (<40 mg / dl dacă pacientul prezintă un alt eveniment cardiovascular)
Epidemiologie
Observatorul epidemiologic cardiovascular / sondajul de examinare a sănătății (OEC / HES) a fost un vast studiu epidemiologic efectuat în 2008-2012 în 23 de municipalități italiene din toate regiunile. [3] În total, au fost examinați peste 9.000 de persoane cu vârste cuprinse între 25 și 79 de ani. La subiecții între 34 și 75 de ani, prevalența hipercolesterolemiei (≥240 mg / dl) a fost de 34% la bărbați și 36% la femei. În grupul de vârstă 35-69 de ani, 8,5% dintre bărbați și 1,1% dintre femei prezentau un risc crescut (≥5% SCORE, ≥20% HEART).
Dieta și colesterolul
Componentele principale ale dietei care cresc nivelul plasmatic al LDL sunt acizii grași saturați, grăsimea mai mică trans-monoinsaturată și colesterolul; Componentele care scad LDL includ acizi grași polinesaturați și, într-o măsură mai mică, fibre de soia și proteine. Acizii grași mononesaturați, cum ar fi acidul oleic , au un efect neutru asupra colesterolemiei. Efectul grăsimilor saturate asupra metabolismului LDL pare să fie legat în principal de reducerea numărului de receptori LDL. Grăsimile saturate sunt deosebit de abundente în carne , lapte și derivate, în ouă . Dimpotrivă, grăsimile polinesaturate, bogate în legături duble, conținute în uleiuri vegetale și pești , joacă un rol protector împotriva hipercolesterolemiei; uleiul de măsline este o excepție, deoarece acidul oleic conține o singură legătură dublă.
Acizii grași polinesaturați omega-3 conținuți în uleiul de pește, pe lângă reducerea colesterolemiei, scad riscul cardiovascular prin acțiuni multiple.
Excesul de carbohidrați din dietă, în special cei cu un indice glicemic ridicat, determină creșterea colesterolului printr-o serie complexă de mecanisme.
În cercetările privind relația dintre dietă și bolile cardiace ischemice, „ipoteza colesterolului” a dominat timp de decenii: colesterolul alimentar a fost considerat principala cauză a colesterolemiei. Cu toate acestea, în anii 1950 , studiile de metabolism efectuate de Groen în Olanda și de Kinsell, Ahrens și Keys din SUA au arătat clar că acizii grași saturați din dietă erau mult mai importanți în creșterea colesterolului, în special a celor cu 12-16 atomi de carbon. Studiile dietetice controlate efectuate între 1970 și 1991 au confirmat că colesterolul total este crescut într-o măsură mai mare de acizi grași saturați specifici decât de colesterol sau carbohidrați și că acizii grași nesaturați tind să-l scadă. Aceste studii au arătat, de asemenea, că toți acizii grași cresc HDL mai mult decât carbohidrații și că efectul se diminuează odată cu gradul de nesaturare. Acizii grași trans-monosaturați pot crește colesterolul plasmatic și pot scădea HDL. Acizii grași trans-nesaturați sunt produsul saturației industriale a acizilor grași polinesaturați în procesul de producție a margarinei .
Studiile clinice, concepute cu scopul de a evalua efectele colesterolului dietetic asupra colesterolemiei, au constatat că există o relație pozitivă între conținutul de colesterol din dietă și creșterea colesterolemiei. O meta-analiză recentă a acestor studii (McNamara, 2000 ), [12] cuprinzând 167 de studii din 1960 până în 1999 care au implicat 3.519 indivizi, a stabilit că pentru fiecare 100 mg de colesterol dietetic zilnic există o creștere medie de 2,2 mg. / Dl de TC, 1,9 mg / dl de LDL și 0,4 mg / dl de HDL, aceasta implică o creștere a raportului LDL / HDL de 0,01 unități. Doar atunci când aportul de colesterol devine deosebit de ridicat (peste 1200 mg pe zi) creșterea colesterolului încetinește treptat, probabil ca o consecință a saturației progresive a mecanismelor de absorbție intestinală. Mai mult, nici conținutul de grăsimi din dietă, nici tipul de grăsime consumat nu par să influențeze creșterea colesterolului pentru fiecare 100 mg de colesterol din dietă. Rezultate similare au produs meta-analiza de către Weggemans (2001) în care raportul TC / HDL a crescut cu 0,04 unități pentru fiecare 100 mg de colesterol din dietă. [13]
S-a estimat că 15-25% din populație are un răspuns exaltat la colesterolul din dietă, în timp ce restul prezintă un răspuns atenuat, cu o diferență între cele două grupuri de aproximativ 300%. Eficiența mecanismelor de feedback, care reglează metabolismul colesterolului, este probabil responsabilă de variațiile individuale ale răspunsurilor la colesterol din dietă.
Colesterolemia și riscul cardiovascular
Studii epidemiologice
Identificarea colesterolemiei ca factor de risc cardiovascular (adică un factor care crește probabilitatea de a dezvolta un eveniment cardiovascular) este rezultatul unei serii lungi de studii epidemiologice care au evidențiat corelația, la subiecții liberi de boli cardiovasculare la momentul inițial, între colesterolemie și evenimente ischemice cardiovasculare, în primul rând infarctul miocardic și mortalitatea cardiovasculară, dintre care infarctul miocardic și accidentul vascular cerebral sunt cele mai frecvente cauze.
Din aceste studii a fost, de asemenea, clar că diferiții factori de risc examinați (hipertensiune, fumat, diabet , obezitate , antecedente familiale de boli ischemice ale inimii și niveluri scăzute de HDL) sunt reciproc puternici, astfel încât cu atât mai numeroși sunt factorii de risc la un singur individ, cu atât este mai mare probabilitatea de deces din cauze cardiovasculare.
În 1990 , Pekkanen, folosind datele din Studiul Prevalenței Programului Clinicilor de Cercetare a Lipidelor ( LRCPPS ), a definit o curbă de mortalitate pentru bolile cardiace ischemice / colesterolemia pentru subiecții cu cardiopatie ischemică anterioară. Această curbă arată o creștere mult mai accentuată a mortalității odată cu creșterea colesterolemiei, tocmai datorită prezenței, la pacienții cardiaci, a multiplilor factori de risc, care interacționează sinergic.
În concluzie, studiile epidemiologice au arătat că colesterolemia totală și, mai ales, valorile LDL și raportul LDL / HDL sunt factori de risc importanți pentru bolile cardiovasculare ischemice; cu toate acestea, studiile epidemiologice în sine ne permit doar să formulăm ipoteze de probabilitate, dar nu sunt capabili să demonstreze o relație cauză-efect, în acest caz între colesterolemie și boli cardiovasculare.
În sprijinul rolului cauzal al colesterolemiei în patologia cardiovasculară, există studii experimentale (deși cu limitările naturii experimentale) și studii clinice. Studiile experimentale au constatat importanța LDL în patogeneza aterosclerozei, în timp ce studiile clinice au arătat că reducerea colesterolemiei este însoțită de fapt de o reducere a evenimentelor cardiovasculare ischemice.
Studii clinice
Scopul studiilor clinice de intervenție a fost reducerea colesterolemiei cu diete sau medicamente și evaluarea rezultatelor prin compararea incidenței evenimentelor ischemice la subiecții tratați comparativ cu subiecții de control tratați cu placebo. Vorbim de studii de prevenție primară atunci când subiecții recrutați nu prezintă, în condiții bazale, semne de boală (în acest caz cardiovasculare), în timp ce studiile de prevenire secundară sunt definite ca fiind cele în care indivizii în cauză suferă deja de patologie.
Deși marea majoritate a studiilor au arătat că reducerea colesterolemiei este însoțită de scăderea evenimentelor ischemice cardiace (fatale și non-fatale), printre toate studiile efectuate înainte de 1994 (anul publicării studiului 4 S , primul studiu major cu statine) ), în doar două studii de prevenție secundară a existat o reducere semnificativă a mortalității prin boală cardiacă ischemică ( Studiul Newcastle , cu clofibrat , 1971 ; Studiul de prevenire secundară a bolii ischemice cardiace din Stockholm , studiu deschis cu clofibrat plus acid nicotinic , 1988 ) și doar într-una dintre ele a redus semnificativ mortalitatea totală ( Stockholm Ischemic Heart Disease Prevention Secondary Study , 1988 ). Cu toate acestea, pentru o interpretare corectă a rezultatelor studiilor clinice, este oportun să se ia în considerare faptul că:
- mortalitatea prin boală cardiacă ischemică la pacienții necoronari (ca în cazul prevenției primare) reprezintă 50% din mortalitatea totală, în timp ce la pacienții coronarieni constituie 80%
- reducerea colesterolului total cu alte medicamente decât statinele este relativ modestă, cu aproximativ 10%
- în grupurile tratate, reducerea absolută (risc absolut) a mortalității cardiovasculare este de câteva puncte procentuale, deși în ceea ce privește reducerea relativă (riscul relativ) procentul poate depăși 20-30%
- la pacienții tratați cu alte terapii decât statinele, impactul mortalității necoronare asupra mortalității totale pare să aibă o pondere mai mare, datorită reducerii relativ modeste a mortalității coronariene.
Rezultatele studiilor clinice efectuate cu statine au demonstrat definitiv că reducerea farmacologică a colesterolemiei duce la o scădere a evenimentelor ischemice și (în cazul 4S , WOSCOP (p = 0,051), LIPID și HPS ) o creștere a supraviețuirii. subiecți netratați, confirmând astfel importanța colesterolemiei ca factor de risc cardiovascular.
Baza fiziopatologică a hipercolesterolemiei
Colesterolul alimentar (colesterol exogen) este absorbit din intestin și este încorporat, împreună cu trigliceride , fosfolipide și apolipoproteine (în principal APOB 48) în chilomicronii formați de celulele epiteliale ale mucoasei intestinale ( enterocite ). Cantitatea maximă zilnică de colesterol absorbabil este de aproximativ 500 mg / zi. După ce chilomicronii și-au eliberat trigliceridele în țesutul adipos, prin acțiunea lipoproteinlipazei endoteliale , particulele rămase se detașează de suprafața endotelială și transportă colesterolul exogen în ficat . [14]
În ficat, o parte din colesterolul exogen este eliminată în bilă , atât ca acizi biliari , cât și ca colesterol liber. Cantitatea de colesterol transformată în săruri biliare (în mod normal, aproximativ 200-400 mg / zi) este reglată de cantitatea de săruri biliare care sunt reabsorbite din intestin și se întorc în ficat (circulația entero-hepatică a acizilor biliari).
O parte mai mare a colesterolului exogen este în schimb încorporată, împreună cu colesterolul sintetizat în ficat (colesterol endogen), în VLDL ( lipoproteine cu densitate foarte mică sau lipoproteine cu densitate foarte mică ). VLDL-urile conțin, de asemenea, trigliceride, fosfolipide și apolipoproteine (în principal APOB 100).
Gradul de biosinteză hepatică a colesterolului endogen este controlat de concentrația intracelulară a colesterolului, prin reglarea activității enzimei hidroximetilglutaril-CoA reductază (HMGCoA-reductază), care transformă hidroximetilglutaril-CoA în acid mevalonic , precursor al colesterolului. O concentrație intracelulară ridicată de colesterol (așa cum se întâmplă în cazul unui aport ridicat de colesterol exogen) inhibă HMGCoA-reductaza și, prin urmare, inhibă și sinteza colesterolului endogen. În acest fel, ficatul încearcă să compenseze o introducere excesivă de colesterol cu alimente, prin reducerea propriei sinteze a colesterolului endogen, încercând să mențină constant nivelul colesterolului. Această influență inversă între colesterolul exogen și endogen se numește reglare negativă a „feedback-ului”. Celălalt mecanism de compensare este reprezentat de eliminarea sărurilor biliare și a colesterolului din bilă, care crește odată cu creșterea aportului de colesterol exogen (mecanismul „feedback” pozitiv). Cu toate acestea, aceste mecanisme de compensare nu sunt total eficiente, deci rezultă că colesterolemia se modifică de obicei în limitele a 15% în funcție de aportul alimentar, deși variațiile extreme ale acestuia pot determina colesterolemia să varieze până la 30% din valoare.
Odată secretate de ficat, VLDL suferă același catabolism ca și chilomicronii: trigliceridele sunt hidrolizate de lipoproteinlipaza endotelială și particulele rămase sau lipoproteinele cu densitate intermediară ( IDL ) sunt eliberate. O parte din IDL este eliminată de hepatocite pentru a fi catabolizată, în timp ce 50-90% este transformat în LDL prin acțiunea lipazei hepatice.
După cum sa văzut deja, LDL sunt principalele lipoproteine responsabile de transportul colesterolului în plasmă și reprezintă o sursă importantă de colesterol pentru țesuturi, deoarece absorbția lor permite celulelor să utilizeze colesterolul (dietetic și hepatic) pentru sinteza membranelor celulare și, în ceea ce privește glandele endocrine , pentru sinteza hormonilor steroizi . Asimilarea LDL de către celule are loc de un receptor specific, prezent pe suprafața celulei, care leagă LDL-urile și le transportă în interiorul celulei, cu un proces numit endocitoză mediată de receptor. Receptorul LDL (LDL-R) leagă APOB 100. 70% din LDL circulant este îndepărtat de ficat, restul de țesuturi periferice.
Creșterea valorilor LDL plasmatice poate fi determinată prin două mecanisme fiziopatologice:
- creșterea producției hepatice de VLDL . Deoarece VLDL sunt precursorii LDL, producția excesivă de VLDL duce în mod necesar la o creștere a LDL plasmatic. În acest caz, hipertrigliceridemia (hiperlipoproteinemia de tip IIb) este asociată cu hipercolesterolemie , deoarece VLDL transportă în principal trigliceridele endogene
- îndepărtarea insuficientă a LDL din circulație din cauza deficitului de receptori specifici LDL-R (sau rar din cauza anomaliilor APOB 100, care se leagă de acești receptori). În acest caz, trigliceridele sunt normale (hiperlipoproteinemie de tip IIa)
Etiologie
Hipercolesterolemia poate fi împărțită în primară sau secundară. Primele nu sunt asociate cu alte boli care pot modifica metabolismul lipidic, în timp ce cele din urmă sunt cauzate de alte boli capabile să influențeze metabolismul lipoproteinelor ( ciroză biliară primară , hepatopatii cu stază biliară, diabet zaharat , hipotiroidism , sindrom nefrotic , utilizează utilizarea prelungită de medicamente precum cortizon și contraceptive orale).
Hipercolesterolemia primară include: de departe cea mai frecventă formă (> 85% din hipercolesterolemia), hipercolesterolemia poligenică și formele familiale mai puțin frecvente, dintre care cea mai frecventă este hipercolesterolemia familială . [14]
Hipercolesterolemie poligenică
Hipercolesterolemia poligenică este o boală cu etiologie multifactorială, cauzată de factori de mediu (dieta bogată în grăsimi saturate și inactivitate fizică) care acționează în prezența factorilor genetici predispozanți; deficitele genetice se referă probabil la mecanismele de feedback, care au fost menționate, compromitând astfel capacitatea organismului de a compensa în mod adecvat excesul de lipide din dietă. Când un exces de colesterol alimentar ajunge în ficat (prin intermediul particulelor de chilomicron rămase), nivelurile ridicate de colesterol intracelular suprimă sinteza receptorilor LDL hepatici și reducerea consecventă a absorbției LDL circulant determină creșterea colesterolemiei. Concentrația totală de colesterol este de obicei cuprinsă între 240 și 350 mg / dl.
Hipercolesterolemie familială
Hipercolesterolemia familială este, de asemenea, cunoscută sub numele de hipercolesterolemie autozomală dominantă de tip 1 (ADH 1). [15] [16] [17] Este o boală de transmitere codozantă autozomală, este asociată cu o mutație a genei care codifică receptorul LDL, situat pe brațul scurt al cromozomului 19 . Forma heterozigotă are o incidență de 1 caz la 500 de indivizi, în timp ce forma homozigotă este mult mai rară (1 caz la un milion de indivizi). Nivelul total al colesterolului din sânge în plasmă este de aproximativ 275–500 mg / dL la heterozigoti și> 500 mg / dL la homozigoti; nivelurile trigliceridelor plasmatice sunt normale.
Terapia cu hipercolesterolemie
Dietă
Terapia hipercolesterolemiei oferă ca o intervenție inițială și esențială o dietă săracă în grăsimi saturate (<7% din totalul caloriilor) și în special în colesterol (<200 mg pe zi). Doar în cazul în care dieta se dovedește ineficientă pentru a obține o reducere satisfăcătoare a colesterolemiei (așa cum se întâmplă foarte des), este avută în vedere consumul simultan de medicamente, care trebuie, în orice caz, să fie însoțit de dietă. Dieta trebuie să fie însoțită de un stil de viață adecvat, care, conform liniilor directoare ale grupului de tratament pentru adulți , trebuie să includă activitate fizică regulată, renunțarea la fumat și reducerea greutății. [18]
Dieta „ Pasul I ” oferă un procent de calorii derivate din acizi grași totali <30% din aportul total de calorii, cu 8-10% din calorii derivate din grăsimi saturate, 10% sau mai puțin din grăsimi polinesaturate și 15% din grăsimi monoinsaturate, în timp ce carbohidrații ar trebui să reprezinte cel puțin 55% din totalul caloriilor, cu o preferință pentru carbohidrații complecși, iar proteinele 15%. Colesterolul nu trebuie să depășească 300 mg pe zi. În cazul unor rezultate nesatisfăcătoare, „ Pasul II ” are restricții suplimentare: colesterol <200 mg pe zi, grăsimi saturate <7% din totalul caloriilor.
Numeroși compuși derivați în mod natural, unii clasificați ca suplimente, s-au dovedit, de asemenea, că au un efect pozitiv asupra controlului hipercolesterolemiei, mai ales dacă este asociat cu alte sindroame metabolice. Cu toate acestea, pentru niciuna dintre ele nu există în prezent suficiente dovezi care să le recomande pentru tratamentul bolii. Printre acestea se numără inozitol , extracte de orez roșu (sursă de Monacolin K), anghinare și păpădie, spirulină , omega-3, glucomanan. [19]
Panoul de tratament pentru adulți (ATP) a dezvoltat o schemă de terapie preventivă pentru bolile cardiace ischemice , bazată pe valorile colesterolului LDL asociate cu riscul general de a dezvolta CHD. Ghidurile actuale ATP III ( 2001 , actualizate în 2004 ) stabilesc valori prag pentru colesterolul LDL, peste care este recomandabil să începeți un tratament farmacologic, pentru a atinge următoarele valori optime:
- > 190 mg / dl LDL pentru niciunul sau un factor de risc. Opțional, pe baza caracteristicilor generale ale pacientului, tratament în cazul colesterolemiei LDL 160–189 mg / dl;
- > 160 mg / dl de LDL pentru 2 sau mai mulți factori de risc, cu riscul de a dezvolta un eveniment cardiovascular în decurs de 10 ani sub 10%;
- > 130 mg / dl de LDL pentru 2 sau mai mulți factori de risc, cu un risc de 10% până la 20% de a dezvolta un eveniment cardiovascular în decurs de 10 ani. Opțional, pe baza caracteristicilor generale ale pacientului, tratament în cazul colesterolemiei LDL 100–129 mg / dl;
- > 100 mg / dl de LDL pentru boli cardiace ischemice sau condiții echivalente, adică un risc mai mare de 20% de a dezvolta un eveniment cardiovascular în decurs de 10 ani (de exemplu, diabet). Opțional, pe baza caracteristicilor generale ale pacientului, tratament în cazul colesterolului LDL <100 mg / dl.
Medicamente
Principalele medicamente indicate pentru tratamentul hipercolesterolemiei includ: statine, fibrate, rășini schimbătoare de ioni, ezetimib , probucol , acid nicotinic (pentru alte medicamente vezi Colesterol).
Statine
Statinele sunt cu siguranță cele mai eficiente medicamente în reducerea nivelului plasmatic al colesterolului LDL, în timp ce acțiunea lor asupra reducerii trigliceridelor și asupra creșterii HDL este relativ mai puțin eficientă. [20] Mărimea reducerii colesterolului LDL care poate fi atinsă prin terapia cu statine este strict dependentă de doză și poate ajunge la o reducere de 55% la doze mari de atorvastatină și rosuvastatină. [21] Mecanismul de acțiune al acestor medicamente constă în inhibarea competitivă a enzimei care reglează sinteza colesterolului (HMGCoA-reductază), cu o acțiune predominantă în ficat (locul sintezei endogene de colesterol). Inhibarea enzimei determină o reducere a concentrației intracelulare a colesterolului; această reducere induce o creștere, la suprafața celulei, a numărului de receptori LDL. Rezultatul este o absorbție crescută a LDL plasmatic de către hepatocite, ceea ce determină o reducere a colesterolemiei.
C'è anche evidenza che le statine inibiscano in qualche misura la sintesi delle VLDL, riducendo in questo modo la trigliceridemia. Inoltre una gran mole di studi sperimentali suggerisce uno spettro nettamente più ampio di azioni, che renderebbero ragione degli ottimi risultati ottenuti con questo tipo di terapia nella riduzione della mortalità e degli eventi ischemici, ictus compreso, anche nei soggetti ad alto rischio (come diabetici o ipertesi) con colesterolemia inferiore a 100 mg/dl. Queste azioni vengono definite come "effetto pleiotropico delle statine" e sembrano, almeno in parte, legate alla inibizione della sintesi degli isoprenoidi, anch'essi derivati dall'HMGCoA. Gli isoprenoidi sono utilizzati dalle cellule per la prenilazione delle proteine, che ne consente l'inserimento nella membrana plasmatica. Un'importante conseguenza è l'inibizione della isoprenilazione delle " small GTP-asi " (o piccole proteine G) e della conseguente inibizione dell'enzima NADP-ossidasi , che comporta una minore produzione di ioni superossido ( radicali liberi ), probabilmente alla base della presunta azione antinfiammatoria delle statine .
L'insieme di queste azioni avrebbe come effetto la stabilizzazione della placca (per riduzione della sua componente lipidica e infiammatoria) e il miglioramento della funzione endoteliale (per aumento, tra l'altro, della liberazione endoteliale di ossido di azoto ). Sebbene studi nell'uomo abbiano attestato l'effetto favorevole delle statine sulla vasodilatazione endotelio-dipendente e sulla placca, si attendono studi che confermino l'importanza clinica di queste azioni.
Gli effetti collaterali più importanti, anche se occorrenti in una bassa percentuale dei casi (<4%), comprendono l'aumento delle transaminasi (indice di danno epatico), di solito transitorio e comunque reversibile con la sospensione della terapia, e soprattutto l'aumento delle creatinchinasi (CPK), indice di danno muscolare; danno che è giunto in alcuni casi fino alla rabdomiolisi e al decesso dei pazienti, come nel caso tristemente famoso della cerivastatina , poi ritirata dal commercio. Per prevenire questi eventi sfavorevoli è perciò opportuno controllare periodicamente sia le transaminasi che, soprattutto, le CPK.
Dei numerosi studi clinici effettuati con le statine non può non essere ricordato, per la mole di pazienti reclutati, lo studio HPS ( Heart Protection Study , 2001 ). In questo trial sono stati esaminati per 5 anni circa 20.000 soggetti ad alto rischio cardiovascolare (diabetici, ipertesi o vasculopatici oppure con pregressa CHD o ictus). La novità principale dello studio è forse da identificare nel fatto che per la prima volta venivano reclutati pazienti con valori di LDL pari o inferiori a 115 mg/dl (circa il 30% dei pazienti), che erano considerati dalle linee guida del momento valori ottimali. Il trattamento con 40 mg di simvastatina ha permesso di ottenere la riduzione di mortalità totale (-12%), mortalità cardiovascolare (-17%), eventi vascolari maggiori (-24%) e ictus ischemico (-27%), in tutti i soggetti trattati, compresi quelli con colesterolemia "normale".
Fra gli studi angiografici si deve segnalare lo studio REGRESS ( Regression Growth Evaluation Statin Study , 1995 ), che ha attestato un rallentamento della progressione delle lesioni aterosclerotiche coronariche, valutate con angiografia , in 885 uomini con coronaropatia e con colesterolemia totale di 155–310 mg/dl, trattati per due anni con 40 mg di pravastatina .
Fibrati
I fibrati rappresentano l'altra grande classe di farmaci ipolipidemizzanti, ma la loro efficacia è rivolta principalmente sui trigliceridi e, in misura minore, sulle LDL e sulle HDL. L'azione dei fibrati è anche rivolta, almeno in parte, alla modulazione dei geni che codificano le lipoproteine. Infatti, i fibrati attivano fattori di trascrizione (fattori che controllano l'attività dei geni) appartenenti alla superfamiglia dei recettori nucleari degli ormoni, chiamati PPAR (Peroxisome Proliferator-Activated Receptors). I fibrati inibiscono la sintesi e stimolano il catabolismo delle VLDL, con il risultato di una notevole riduzione della trigliceridemia e di una minore diminuzione della colesterolemia. In particolare, attraverso PPAR viene inibita la sintesi dei trigliceridi endogeni, mentre viene stimolata la sintesi della lipoproteinlipasi (l'enzima che catabolizza le VLDL, trasformandole in IDL). L'attivazione di PPAR-alfa media l'azione dei fibrati sulle HDL, in quanto induce la sintesi delle principali apolipoproteine delle HDL (APOA-I e APOA-II). Per la loro azione prevalente sui trigliceridi, i fibrati sono indicati soprattutto per il trattamento delle ipertrigliceridemie isolate e per le forme combinate di ipertrigliceridemia e ipercolesterolemia. La riduzione dei trigliceridi è di circa 20-50%, mentre la riduzione delle LDL di solito non va oltre il 25% e l'aumento delle HDL del 10-25%. In studi di prevenzione primaria e secondaria il gemfibrozil ha ridotto gli eventi coronarici.
Resine a scambio ionico
Le resine a scambio ionico sono usate meno frequentemente rispetto ai farmaci precedenti e di solito in associazione con questi. Le resine non vengono assorbite dall'intestino, cosicché la loro azione si esplica esclusivamente nel lume intestinale, dove legano i sali biliari e ne riducono drasticamente il riassorbimento. Ciò compromette il normale ricircolo entero-epatico dei sali biliari e gli epatociti rispondono a questo deficit aumentando la quantità di colesterolo che viene convertito in acidi bilari; attraverso questo meccanismo si ottiene la riduzione della colesterolemia del 15-30% circa.
Ezetimibe
Di più recente introduzione, l'ezetimibe, farmaco ipolipidemizzante, attivo per via orale, inibitore dell'assorbimento intestinale del colesterolo, primo di una nuova e interessante classe di farmaci. Il suo meccanismo di azione consiste nella inibizione della proteina Niemann-Pick C1-like, che trasporta il colesterolo dal lume intestinale nell'enterocita, modulando in tal modo l'assorbimento del colesterolo biliare e alimentare, nonché dei fitosteroli correlati. L'ezetimibe è in commercio solo come associazione precostituita con la simvastatina, ma ha dimostrato benefici clinici anche quando impiegato da solo o in associazione ad altre statine.
Note
- ^ ( EN ) WT Friedewald, Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge ( PDF ), in Clin. Chem. , vol. 18, 1972, pp. 499-502.
- ^ ( EN ) Goldman-Cecil Medicine , 25ª ed., Philadelphia, Elsevier-Saunders, 2016, p. 1395, ISBN 978-1-4557-5017-7 .
- ^ a b MM Gulizia, Colesterolo e rischio cardiovascolare: percorso diagnostico-terapeutico in Italia ( PDF ), in G. Ital. Cardiol. , vol. 17, Suppl.1, 2016, p. 6S.
- ^ ( EN ) Lowering blood cholesterol to prevent heart disease. NIH Consensus Development Conference statement , in Arteriosclerosis , vol. 5, 1985, pp. 404-412.
- ^ ( EN ) JA Damen, Prediction models for cardiovascular disease risk in the general population: systematic review , in BMJ , vol. 353, 2016, p. i2416.
- ^ ( EN ) SS Mahmood, The Framingham Heart Study and the epidemiology of cardiovascular disease: a historical perspective , in Lancet , vol. 383, 2014, pp. 999-1008.
- ^ ( EN ) MJ Pencina,Predicting the 30-year risk of cardiovascular disease: the framingham heart study. , in Circulation , vol. 119, 2009, pp. 3078-3084.
- ^ ( EN )Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report , in Circulation , vol. 106, 2002, pp. 3143-3421.
- ^ ( EN ) NJ Stone, 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines , in Circulation , vol. 129, Suppl. 2, 2014, pp. S1-45.
- ^ ( EN ) AD Hendrani, Dyslipidemia management in primary prevention of cardiovascular disease: Current guidelines and strategies , in World J. Cardiol. , vol. 8, 2016, pp. 201-210.
- ^ ( EN ) AL Catapano, 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias , in Eu. Heart J. , vol. 37, 2016, pp. 2999-3058.
- ^ ( EN ) DJ McNamara, The impact of egg limitations on coronary heart disease risk: do the numbers add up? McNamara DJ1. ( abstract ), in J. Am. Coll. Nutr. , vol. 19, Suppl.5, 2000, pp. 540S-548S.
- ^ ( EN ) RM Weggemans, Dietary cholesterol from eggs increases the ratio of total cholesterol to high-density lipoprotein cholesterol in humans: a meta-analysis , in Am. J. Clin. Nutr. , vol. 73, 2001, pp. 885–891.
- ^ a b ( EN ) H. Soran, Hypercholesterolaemia – practical information for non-specialists , in Arch. Med. Sci. , vol. 14, 2018, pp. 1–21.
- ^ ( EN ) DL Kasper, Harrison's principles of internal medicine , 19ª ed., McGraw-Hill education, 2015, p. 2441, ISBN 978-0-07-180216-1 .
- ^ ( EN ) JL Jameson, Endocrinology , 7ª ed., Elsevier-Saunders, 2016, p. 723, ISBN 978-0-323-18907-1 .
- ^ ( EN ) L. Goldman, Goldman-Cecil medicine , 25ª ed., Elsevier-Saunders, 2016, p. 1393, ISBN 978-1-4557-5017-7 .
- ^ ( EN ) GS Mannu, Evidence of lifestyle modification in the management of hypercholesterolemia , in Curr. Cardiol. Rev. , vol. 9, 2013, pp. 2-14.
- ^ ( EN ) Teresa Esposito, Salvatore Allocca e Laura Adelfi, Effects of Monacolin K of Red Rice and Glucomannan, Combined with a Low Calorie Diet, in Treatment of Dyslipidemia and Hypertension , in Biology and Medicine , vol. 07, n. 05, 12 settembre 2015, DOI : 10.4172/0974-8369.1000250 . URL consultato il 27 agosto 2017 (archiviato dall' url originale il 17 agosto 2016) .
- ^ ( EN ) UK Sampson, Residual cardiovascular risk despite optimal LDL cholesterol reduction with statins: the evidence, etiology, and therapeutic challenges , in Curr. Atheroscler. Rep. , vol. 14, 2012, pp. 1-10.
- ^ ( EN ) TC Weng, A systematic review and meta-analysis on the therapeutic equivalence of statins ( abstract ), in J. Clin. Pharm. Ther. , vol. 35, 2010, pp. 139–151.
Voci correlate
- Acido pantotenico
- Aterosclerosi
- Bile
- Colesterolo
- Colelitiasi
- Determinazione del colesterolo
- Infarto del miocardio
- Metabolismo dei lipidi
- Niacina
- Perossisoma
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su ipercolesterolemia
Wikimedia Commons contiene immagini o altri file su ipercolesterolemia
Collegamenti esterni
- ( EN ) Seven Contries Study , su epi.umn.edu .
- ( EN ) The Framingham Heart Study , su framingham.com .
- ( EN ) The Pooling Project of Prospective Studies of Diet and Cancer , su hsph.harvard.edu .
- ( EN ) Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) , su nhlbi.nih.gov . URL consultato il 18 gennaio 2006 (archiviato dall' url originale il 5 agosto 2012) .
- ( EN ) L'abstract di The Lipid Research Clinics Coronary Primary Prevention Trial , su archinte.ama-assn.org .
- ( EN ) MRC/BHF Heart Protection Study , su ctsu.ox.ac.uk .
- ANIF - Associazione Nazionale Ipercolesterolemia Familiare (ONLUS) , su anif.it .
| Controllo di autorità | Thesaurus BNCF 35078 · LCCN ( EN ) sh85063682 · BNF ( FR ) cb119652910 (data) · NDL ( EN , JA ) 00566728 |
|---|