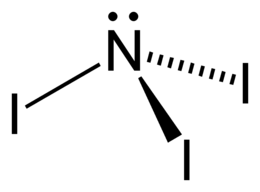
Nitrură de iod
Această intrare sau secțiune despre săruri și explozivi nu menționează sursele necesare sau cei prezenți sunt insuficienți . |
| Nitrură de iod | |
|---|---|
| Numele IUPAC | |
| Triiodură de azot | |
| Caracteristici generale | |
| Formula moleculară sau brută | NI 3 |
| Masa moleculară ( u ) | 394,77 g / mol |
| Aspect | roșu închis solid |
| numar CAS | |
| PubChem | 61603 |
| ZÂMBETE | N(I)(I)I |
| Proprietăți fizico-chimice | |
| Temperatură de topire | sublimează la -20 ° C |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
| | |
Nitrura de iod , denumită în mod tradițional triiodură de amoniu sau triiodură de azot este un exploziv puternic produs de reacția iodului I 2 cu amoniacul NH 3 .
Proprietate
Este extrem de sensibil la șocuri, de fapt, chiar și folosind doar câteva cristale, deci un număr foarte mic, dacă este atins cu o pană, explodează violent emițând un zgomot similar cu cel al prafului de pușcă și, de asemenea, un nor violet de vapori de iod . Dacă este uscat, poate exploda numai din cauza expunerii la lumina soarelui, chiar dacă este acumulat în cantități mici. Într-adevăr, dacă este îngrămădit în cantități suficient de mari, acesta explodează sub propria greutate. Reacția este rezumată aici:
2NI 3 → N 2 ↑ + 3I 2 ↑ ΔH = –290 kJ / mol
Triiodura de azot pur este un compus de culoare închisă, sintetizat pentru prima dată de Bernard Courtois în 1812, care a caracterizat compoziția și proprietățile aductului său cu amoniac, NI 3 · NH 3 . Tehnica de sinteză utilizată din 1990 pentru a crea NI 3 pur în condiții de siguranță a fost de a reacționa nitrura de bor cu monofluorura de iod în triiodofluorometan la -30 ° C.
În laboratoarele școlare de chimie încă se produc cantități mici pentru a demonstra instabilitatea unor compuși.
Utilizări
Triiodura de azot nu a fost folosită niciodată în scopuri militare sau ca exploziv ca detonatoare datorită instabilității sale foarte mari. Când este umed, triiodura de azot este mai puțin sensibilă, dar se recomandă prudență extremă la manipularea acesteia. Apa spală doar cu dificultate petele compusului de pe haine. În acest scop, o soluție de alcool etilic este mai eficientă.
Sinteză
Producția acestui exploziv este foarte periculoasă și ilegală în Italia , nu pentru utilizarea reactivilor, ci pentru sensibilitatea foarte mare pe care o are produsul atunci când este uscat.
Se poate obține pur și simplu adăugând iod pulverizat la o soluție apoasă de amoniac (5-30%) în exces; reacția durează de la câteva minute la câteva ore în funcție de cantitățile de reactanți și de concentrația soluției și se caracterizează prin producerea de bule de hidrogen . Reacția este următoarea:
Când se termină producția, nitrura de iod va fi depusă pe fundul recipientului. În acest moment, compusul obținut nu este instabil ca și cum ar fi „uscat”, atât pentru că este umed, cât și pentru că există un exces de amoniac prezent care îl stabilizează formând un complex. Drept dovadă, dacă este filtrat, transferat în apă pură și bătut, pot fi observate micro-explozii (deși periculoase).
Prin urmare, nitrura de iod poate fi manipulată în limitele siguranței numai în soluție apoasă de amoniac de cel puțin 5%, întotdeauna cu mare prudență. Pentru a-l detona, trebuie deja uscat la aer în locul prestabilit, deoarece odată uscat este suficient să-l atingeți cu o pană pentru a-l face să explodeze. Sinteza cantităților mai mari de câteva grame nu este recomandată deoarece compusul poate exploda sub propria greutate. Din toate aceste motive, o sinteză în alte scopuri decât cele educative sau recreative este de neconceput.
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe azotură de iod
Wikimedia Commons conține imagini sau alte fișiere pe azotură de iod