Fibrilatie atriala
| Fibrilatie atriala | |
|---|---|
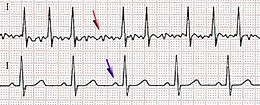
| Electrocardiograma fibrilației atriale (deasupra) și ritmul cardiac normal (deasupra) | |
| Specialitate | cardiologie |
| Clasificare și resurse externe (EN) | |
| OMIM | 613120 , 611819 și 615770 |
| Plasă | D001281 |
| MedlinePlus | 000184 |
| eMedicină | 151066 |
Fibrilația atrială este o modificare a ritmului cardiac ( aritmie ) care provine din atriile inimii . Este o patologie electrică complexă a atriilor, eterogenă din punct de vedere fiziopatologic și clinic, adesea multifactorială, care prezintă în mod constant două caracteristici: activarea electrică rapidă și aparent haotică a țesutului atrial și riscul tromboembolic crescut [1] [2 ] .
Fibrilația atrială este rezultatul unui număr mare de tulburări cardiace și extracardiace: de la boli structurale, cum ar fi valvulopatiile și cardiomiopatiile , la hipertensiunea arterială , la bolile genetice ereditare, la distiroidism, până la cazurile în care nu este posibil să se determine cauza , numit idiopatic .
Abordarea clinică actuală, pe lângă abordarea patologiei cardiace sau extracardiace, are ca scop tratarea simptomelor și minimizarea incidenței embolismelor și insuficienței cardiace .
Recomandările - larg împărtășite în literatura de specialitate - privind alegerea terapeutică, în sens strict aritmologic , se bazează pe alternativa dintre [1]
- controlul ritmului (adică recuperarea și menținerea ritmului sinusal cu medicamente antiaritmice sau ablația cateterului );
- controlul ritmului cardiac cu medicamente care reglează conducerea stimulilor atriali către ventriculii asociați cu terapia antitrombotică.
Numeroase studii randomizate nu au arătat niciun beneficiu de mortalitate la pacienții tratați cu medicamente antiaritmice utilizate până acum pentru controlul ritmului comparativ cu cei tratați doar pentru controlul ratei [3] [4] [5] [6] .
Până în prezent, nu se știe dacă strategia de control al ritmului cu ablația cateterului îmbunătățește mortalitatea față de controlul simplu al ritmului cardiac. Se desfășoară un studiu randomizat care compară ablația cu terapia medicamentoasă [7] .
Alegerea conduitei terapeutice este deci personalizată pe baza diferiților factori:
- varsta,
- toleranță hemodinamică,
- extinderea simptomelor,
- momentul apariției fibrilației,
- istoricul recăderilor anterioare și durata acestora,
- probabilitatea mare de recidivă,
- reversibilitatea condițiilor cauzale,
- prezența și severitatea bolilor cardiace structurale de bază,
- mărimea atriilor și prezența remodelării structurale,
- toleranța la medicamentele antiaritmice și anticoagulante ,
- asteptarile pacientului.
Epidemiologie
Fibrilația atrială este cea mai frecventă formă de aritmie , după extrasistol . 1-2% din populație este afectată de fibrilația atrială; cu toate acestea, prevalența este probabil mai apropiată de 2%, ținând cont de numărul mare de cazuri nediagnosticate [8] [9] . Bărbații au o prevalență mai mare decât femeile. Incidența (numărul de cazuri noi pe an) a crescut cu 13% în ultimii 20 de ani. Riscul de a avea fibrilație atrială în restul vieții la persoanele cu vârsta de 40 de ani este de aproximativ 25%.
Condiții asociate și factori de risc
Toate bolile cardiace și multe boli extracardiovasculare pot fi asociate, ca factor cauzal sau ca factor de risc sau ca o consecință, fibrilației atriale. În special, multe dintre aceste condiții pot fi concomitente: această polimorbilitate are un efect aditiv în determinismul aritmiei.
- Vârstă : îmbătrânirea crește incidența fibrilației atriale. Prevalența aritmiei în populația generală crește de la 0,5-4,5% la 40-45 de ani, la 5-10% la 45-50 de ani la 10-15% la 80 de ani, ajungând la 18% la populația de 85 de ani sau mai vechi [10] . Riscul de a avea fibrilație atrială în restul vieții este de aproximativ 25% la persoanele cu vârsta de 40 de ani [11] [12] ;
- Hipertensiune arterială [13] ;
- Insuficiență cardiacă : prezentă la 30% dintre pacienții cu fibrilație atrială. Aritmia poate provoca decompensare fie prin promovarea cronică a miopatiei tahicardice, fie prin provocarea insuficienței cardiace acute datorită ratei ventriculare ridicate. Insuficiența cardiacă poate, la rândul său, provoca fibrilație atrială prin creșterea volumului și presiunii atriale sau prin disfuncție secundară a valvei sau prin stimularea mecanismelor de adaptare neuroendocrină [14] ;
- Valvulopatii : fibrilația atrială este prezentă în aproximativ 30% din valvulopatii, mai devreme în istoria naturală a stenozei și insuficienței mitrale , mai târziu în valvulopatiile aortice ;
- Cardiomiopatii idiopatice: dilatate , hipertrofice [15] , restrictive ;
- Disfuncția nodului sinusal : în asociere cu fibrilația atrială configurează sindromul bradi-tachi ;
- Boli cardiace congenitale : mai presus de toate defectele septului atrial, ventriculul unic, transpunerea marilor artere după intervenția chirurgicală a muștarului, după intervenția chirurgicală conform lui Fontan;
- Boală cardiacă ischemică : prezentă la 20% dintre pacienții cu fibrilație atrială;
- Disfuncții tiroidiene : pot provoca fibrilație atrială (de asemenea ca singurul factor cauzal) în ordine hipertiroidismului , hipotiroidismului și disfuncțiilor subclinice ale glandei tiroide [16] ;
- Obezitate : este prezentă la 25% dintre pacienții cu fibrilație atrială [17] ;
- Diabet zaharat : este prezent la 20% dintre pacienții cu fibrilație atrială;
- Boală pulmonară obstructivă cronică : este prezentă la 10,15% dintre pacienții cu fibrilație atrială;
- Embolie pulmonară și hipertensiune pulmonară primară și secundară;
- Boală renală cronică : este prezentă la 10-15% dintre pacienții cu fibrilație atrială;
- Sindrom de apnee obstructivă în somn [18] ;
- Consumul de alcool [19] ;
- Chirurgie cardio-toracică [20] [21] ;
- Fumul de tutun [22] ;
- Exerciții fizice viguroase sau prelungite (sportivi) [23] [24] ;
- Găsirea ecocardiografică a dilatației atriului stâng , scăderea funcției sistolice a ventriculului stâng (evaluată ca Fracție de ejecție ), îngroșarea pereților ventriculului stâng, creșterea indicilor de presiune end-diastolică a ventriculului stâng [25] ;
- Creșterea unor indici biohumorali de inflamație ( proteină C-reactivă ) [26] și a insuficienței ventriculare stângi ( pro-BNP ) [27] .
Clasificare
Clasificarea și nomenclatura diferitelor forme de fibrilație atrială se bazează pe criteriul duratei sau al intervențiilor terapeutice sau al asocierii cu alte patologii [28] . Nomenclatura diferitelor tipuri de fibrilație atrială:
- Fibrilație atrială cu debut nou : Fibrilație documentată pentru prima dată, indiferent de prezența simptomelor sau de orice episoade anterioare nedocumentate.
- Fibrilație atrială paroxistică : fibrilație care se termină spontan în 48 de ore sau 7 zile de la debut (în funcție de instrucțiuni: limita de 48 de ore a fost stabilită deoarece este considerată perioada maximă de timp care permite cardioversia imediată cu risc embolic scăzut; limita de zi a fost stabilită deoarece este perioada în care remisia spontană a aritmiei are loc cel mai frecvent).
- Fibrilație atrială persistentă : Fibrilația atrială continuă care durează mai mult de 48 de ore sau 7 zile (în funcție de recomandări) sau care este întreruptă cu cardioversie farmacologică sau electrică după această limită.
- Fibrilație atrială persistentă de lungă durată: Fibrilație atrială continuă care durează mai mult de 12 luni. Această durată este importantă, deoarece se corelează cu probabilitatea de succes a cardioversiei sau ablației trans-cateterice.
- Fibrilație atrială permanentă : termenul este utilizat atunci când pacientul și medicul decid în comun să accepte fibrilația atrială și renunță la încercări ulterioare de restabilire și menținere a ritmului sinusal. Prin urmare, nu se referă la caracteristicile fiziopatologice ale aritmiei, deoarece decizia depinde de boala cardiacă subiacentă, de simptome, de eficacitatea terapiilor și de preferința pacientului și a medicului.
- Fibrilația atrială non-valvulară : Fibrilația atrială în absența stenozei mitrale reumatice, a protezei mecanice sau biologice a valvei sau a reparării valvei mitrale (distincția de cea asociată bolii valvei este importantă în alegerea terapiei anticoagulante).
- Fibrilație atrială silențioasă (sau asimptomatică): Fibrilație atrială care nu este asociată cu simptome, indiferent de alte caracteristici. Poate fi diagnosticat în urma unei complicații legate de FA, cum ar fi accident vascular cerebral ischemic sau tahicardiomiopatie, sau incidental cu o electrocardiogramă.
- Fibrilația atrială secundară : Fibrilația atrială în care poate fi identificată cauza aritmiei sau o afecțiune cardiacă sau extracardiacă favorabilă.
- Fibrilație atrială primară sau izolată (fibrilație atrială singură ): fibrilație atrială neasociată cu boli cardiovasculare, inclusiv hipertensiune arterială sau alt factor cauzal cunoscut. Prin urmare, diagnosticul este unul de excludere și necesită efectuarea investigațiilor clinice și instrumentale indicate pentru caz. În general, se referă la tineri aparent sănătoși sau la persoane cu vârsta <60 de ani. Absența constatărilor patologice în examinările neinvazive nu exclude complet patologiile anterioare sau actuale. În biopsiile miocardice atriale multiple ale acestor pacienți, modificările histologice de tip predominant inflamator sau fibrotic sunt frecvente [29]
Electrocardiogramă și diagnostic
Se caracterizează pe electrocardiograma de suprafață prin absența undelor P distincte (adică absența undelor normale de activare atrială la origine fiziologică din nodul sinusal ); în schimb, există așa-numitele unde F , cu morfologie și tensiune variabile, cu un ciclu variabil (sau interval între două activări), dar în orice caz mai puțin de 200 ms (corespunzător frecvenței de 300 bătăi / m) - mai ales frecvența este de 400-600 bătăi / m - ceea ce conferă izoelectricului un aspect zimțat. Intervalele RR (adică intervalele dintre două bătăi corespunzătoare activării electrice a ventriculilor) sunt complet neregulate fără a urma un model repetitiv. Acesta este motivul pentru care fibrilația atrială a fost numită aritmie totală. Durata minimă pentru definirea fibrilației atriale pe o urmă electrocardiografică este de 30 sec. [30] .
Având în vedere neregularitatea aritmiei, ritmul cardiac este măsurat ca „frecvență ventriculară medie”, adică prin numărarea tuturor bătăilor (complexe QRS) prezente într-un minut și nu extrapolând de la intervale mai scurte.
Neregularitatea bătăilor ventriculare determină neregularitatea pulsurilor palpabile în pulsurile arteriale periferice (de obicei artera radială ). Suspiciunea de diagnostic vine din prezența unui puls rapid și neregulat, dar diagnosticul trebuie să fie electrocardiografic. Chiar și succesiunea neregulată a extrasistolelor poate de fapt imita fibrilația atrială într-un puls rapid.
Diagnosticul diferențial cu alte aritmii ar trebui să ia în considerare: tahicardie supraventriculară și flutter atrial (care au cicluri atriale de obicei mai mari de 200 ms) și succesiunea ectopiilor ( extrasistole ), uneori intervale RR foarte scurte pot acoperi în electrocardiogramă ritmul atrial: poate fi apoi necesar pentru a încetini conducerea atrioventriculară cu manevre vagale sau medicamente ( adenozină , blocanți ai canalelor de calciu non-hidropiridinici) pentru a scoate valurile f. Uneori, administrarea de medicamente antiaritmice poate prelungi ciclurile atriale (durata mai mare de 200 ms).
Fiziopatologie
Fibrilația atrială este determinată de interacțiunea a trei factori:
- declanșatorul, stimulul electric care îl inițiază;
- substratul, țesutul miocardic atrial vulnerabil care permite inițierea și menținerea acestuia;
- contextul metabolic (în special concentrația de electroliți) și neuroendocrin (simpatic și parasimpatic).
În ciuda progreselor în cercetările experimentale și clinice, fiziopatologia fibrilației atriale nu a fost încă pe deplin elucidată. Cea mai importantă descoperire recentă a fost identificarea declanșatoarelor (bătăi ectopice) provenite din venele pulmonare de către Michel Haïssaguerre [31] . Se crede că, trecând de la forma paroxistică la cea persistentă, importanța declanșatorului face loc substratului (modificări miocardice) în patogeneza aritmiei [32] Au fost identificate, atât în modele animale, cât și în medii clinice la om. , trei mecanisme responsabile de fibrilația atrială:
- mecanism focal datorat descărcării rapide a unui singur focar stabil sau multiplu și a conducerii fibrilatorii în atriu;
- fronturi multiple de undă reentrantă [33] ;
- rotoare relativ stabile care produc alți rotoare tranzitorii și conducere fibrilatorie în atrii [34] .
Aceste mecanisme diferite pot fi legate de substraturi diferite și, de asemenea, de factori genetici sau biomoleculari individuali diferiți [35] .
Predispozitie genetica
Unele boli cardiace moștenite sunt asociate cu o incidență ridicată a fibrilației atriale: sindrom QT lung, sindrom QT scurt, sindrom Brugada, cardiomiopatie hipertrofică [36] . Au fost de asemenea identificate forme familiale de fibrilație atrială asociate cu mutații genetice . Genele implicate sunt cele ale peptidei natriuretice atriale, gena SCN5A a canalului de sodiu, a canalului de potasiu, loci apropiate de genele PITX2 și ZFHX3, gena PRKAG [37] [38] .
Remodelare
Odată ce fibrilația s-a stabilit, țesutul atrial suferă o „remodelare electrică” și „structurală”, adică schimbări mai întâi în caracteristicile electrofiziologice și apoi în structura miocardului. Aceste modificări devin din ce în ce mai stabile în corelație cu durata aritmiei, scăzând astfel probabilitatea de a restabili ritmul sinusal normal sau de a-l menține după cardioversie. De fapt, sintagma este acum acceptată: „fibrilația atrială favorizează fibrilația atrială” („AF generează AF”) [39] .
Remodelare electrică
Constă din modificări electrofiziologice ale fibrelor musculare miocardice: scurtarea perioadei efective refractare atriale (ERP), pierderea adaptării ERP la ritmul cardiac, încetinirea vitezei de conducere atrială, neomogenitatea vitezei de conducere și a ERP în diferitele fibre atriale, pierderea adaptării duratei potențiale de acțiune la ritmul cardiac [40] . Din punct de vedere molecular, la baza acestor modificări ar exista variații ale curenților ionici ai membranei induși de fibrilația atrială. În special, s-au demonstrat scăderi ale ICaL Ito și Ikur, creșterea Ik1, IkACh și Iks. Creșterea calciului intracelular duce la activarea Calcineurinei dependente de Ca și a sistemului Calciul / Calmodulin kinazei II (aceleași căi sunt implicate în apoptoză sau moartea celulară [41] . Hiperfosforilarea Connessinei 43 a fost demonstrată și cu alterarea conducției a potențialului de acțiune în joncțiunile dintre miocite [42] .
Remodelare structurală
Fibrilația atrială determină fibroza interstițială a țesutului atrial și, la rândul său, fibroza facilitează perpetuarea fibrilației atriale. Acest cerc vicios a fost demonstrat în modele animale și la oameni. Biopsiile atriului au arătat fibroză atât la inimile decompensate, cât și la fibrilația atrială izolată; iar cantitatea de fibroză crește odată cu durata aritmiei [43] . Fibroza interstițială a atriului pare să fie legată de activarea a două căi de reglare: sistemul renină-angiotensină și factorul de creștere transformant-β1 ( TGF -β1). Acestea sunt activate ca răspuns la întinderea peretelui și la insuficiența cardiacă [44] . Aceste observații sunt deosebit de importante pentru demonstrarea eficacității medicamentelor inhibitoare ECA în încetinirea cronicității fibrilației atriale.
La baza remodelării electrice și structurale par să existe și alte două mecanisme: creșterea stresului oxidativ și intervenția factorilor de inflamație [45] . O creștere a oxidului de azot endotelial sintetază și nicotinamidă adenină dinucleotid fosfat oxidază (NOX) a fost demonstrată în modele experimentale de fibrilație atrială, ducând la o creștere a superoxizilor și peroxizilor, responsabili de activarea inflamației , apoptozei și fibrozei [46] . Aceleași căi pot fi implicate în reglarea canalelor ionice de membrană și în reglarea calciului intracelular. Acestea au fost, de asemenea, legate de factorul de necroză tumorală-α, interleukina 1β și metaloproteinaze (metaloproteinaze cu matrice matricială MMPs). Markerii inflamației pot fi crescuți în fibrilația atrială clinică [26] [47]
Caracteristici hemodinamice
În ritmul cardiac normal, impulsul generat de nodul sinoatrial determină contractarea mușchiului inimii și permite pomparea sângelui . În fibrilația atrială, impulsurile electrice care dau naștere la contracția atriilor sunt activate într-un mod total haotic și fragmentar, dând naștere fronturilor multiple de undă și contracții dezorganizate și fragmentare. Aceste contracții ale miocardului atrial sunt ineficiente din punct de vedere hemodinamic, astfel încât funcția de pompă a inimii, exercitată în principal prin contracții ventriculare, pierde contribuția sistolei atriale. În absența altor boli de inimă, acest lucru nu afectează în mod semnificativ funcția pompei , de fapt contribuția contracției atriale este de aproximativ 20-30% din volumul total diastolic.
Cu toate acestea, pierderea contracției atriale, neregularitatea și adesea accelerarea bătăilor inimii și creșterea presiunii de umplere pot afecta funcția ventriculară stângă, în moduri diferite, la efort, și, prin urmare, toleranța la efort poate fi redusă. În plus, fibrilația atrială este un factor de risc major pentru accidentul vascular cerebral ischemic. Aproximativ o cincime din accidentele vasculare cerebrale se datorează acestei aritmii. De asemenea, constituie un factor de risc pentru o reducere a capacității cognitive, pentru spitalizări repetate și, în general, poate duce la o reducere a calității vieții.
Mortalitatea la pacienții cu fibrilație atrială este de două ori mai mare decât la pacienții neafectați. Terapia antitrombotică este singura care a demonstrat o reducere a mortalității la acești pacienți [48] .
.
Mecanisme electrofiziologice
Conform teoriei multiplelor valuri de undă, numeroase fronturi de undă sunt conduse în peretele atrial într-un mod haotic și suferă fenomene de fuziune și interacțiune reciprocă. Aceste evenimente duc la anularea continuă a fronturilor de undă și la generarea de noi fronturi, într-un mod la fel de haotic. Acest mecanism permite perpetuarea aritmiei.
Clinica
Simptomatologie
Un simptom al FA este palpitația : pacientul simte un sentiment subiectiv de bătăi neregulate ale inimii, care poate fi însoțit de lipsă de aer sau leșin atunci când ritmul bătăilor inimii ventriculare devine deosebit de mare. În cazuri deosebit de severe, un pacient care are deja boli de inimă poate suferi de insuficiență cardiacă . L ' astenia , adică oboseala fizică, este un simptom mereu prezent în FA.
Terapie
- FA paroxistică la subiecții sănătoși: la subiecții sănătoși, restabilirea ritmului sinusal ( cardioversia ) are loc spontan în aproximativ 60% din cazuri, în primele ore după episodul acut. Dacă nu există cardioversie spontană, cardioversia farmacologică poate fi încercată administrând medicamente antiaritmice precum propafenonă , flecainidă sau, în cazul bolilor cardiace structurale concomitente, în special contractilitate redusă, amiodaronă . Acest lucru se datorează faptului că antiaritmicele de clasă Ic (propafenonă și flecainidă) determină o reducere importantă a contractilității.
- AF la pacienții cardiopatici care nu prezintă insuficiență cardiacă: conversia la ritm sinusal (ritm normal) poate avea loc prin administrarea de propafenonă sau amiodaronă, dacă nu se poate obține un ritm sinusal, trebuie programată o cardioversie electrică. Înainte de a supune pacientul la cardioversie, se recomandă - pentru a preveni detașarea trombilor de atrii, cu embolii consecvente - un tratament anticoagulant adecvat, de exemplu, cu heparină , dacă aritmia a apărut mai puțin de 48 de ore sau cu administrare orală. terapie anticoagulantă , utilizând warfarină sau acenocumarol , în toate celelalte cazuri [49] .
- AF la subiectul cu insuficiență cardiacă: restabilirea ritmului sinusal trebuie căutată folosind cardioversia electrică externă.
Dacă cardioversia FA nu a fost realizată sau dacă există FA permanentă, terapia ar trebui să vizeze controlul ritmului cardiac cu medicamente precum digitalis , beta - blocante , verapamil sau diltiazem, în timp ce riscul de tromboembolism va fi redus cu utilizarea orală anticoagulante, care până acum erau reprezentate de warfarină și acenocumarol . Cu toate acestea, aceste medicamente necesită control periodic al nivelului de anticoagulare prin prelevarea de probe de sânge.
Medicamentele anticoagulante au fost recent aprobate, care nu vor mai necesita controale hematologice; aceste medicamente noi, dabigatran , rivaroxaban și apixaban , au fost evaluate, respectiv, în următoarele studii: RE-LY, ROCKET-AF și ARISTOTELE [50][51] [52] .
Este de înțeles că simplificarea în controlul terapiei cronice este punctul forte al acestor substanțe noi. Indicațiile pentru utilizarea lor, în acest moment, sunt practic prevenirea accidentului vascular cerebral în fibrilația atrială cronică și prevenirea tromboembolismului (tromboză venoasă profundă și embolie pulmonară în chirurgia ortopedică).
În unele cazuri, când pachetul de conducere către ventriculi este deteriorat și, prin urmare, ritmul cardiac este deosebit de scăzut, va fi implantat un stimulator cardiac definitiv. În cazurile de FA cronică sau recidivantă la pacienți selectați, în care nu este posibilă menținerea ritmului sinusal în timp, în ultimii ani se propune ablația cateterului cu radiofrecvență : această metodă este eficientă în prezent în aproximativ 70% din cazuri.
Printre noile medicamente, pentru cardioversia farmacologică, se numără vernakalantul , aprobat pentru utilizare în Europa în 2010 [53] .
Notă
- ^ a b ( EN ) ianuarie CT și colab. , 2014 AHA / ACC / HR, ghid pentru managementul pacienților cu fibrilație atrială: rezumat: un raport al American College of Cardiology / American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society , în J Am Coll Cardiol , n. 64, 2014, pp. 2246-2280. Adus pe 27 octombrie 2018 .
- ^ (EN) David Brieger și colab. , Fundația Națională a Inimii din Australia și Societatea Cardiacă din Australia și Noua Zeelandă: Ghiduri clinice australiene pentru diagnosticul și gestionarea fibrilației atriale 2018 , vol. 27, n. 10, 2018, pp. 1209-1266. Adus pe 27 octombrie 2018 .
- ^ Roy D și colab. , Investigatorii privind fibrilația atrială și insuficiența cardiacă congestivă. Controlul ritmului versus controlul ritmului pentru fibrilația atrială și insuficiența cardiacă , în N Engl J Med , n. 358, 2008, pp. 2667-2677, DOI : 10.1056 / NEJMoa0708789 , PMID 18565859 .
- ^ Wyse DG și colab. , Investigatorii de urmărire a fibrilației atriale pentru gestionarea ritmului (AFFIRM). O comparație a controlului ratei și controlului ritmului la pacienții cu fibrilație atrială , în N Engl J Med , n. 347, 2002, pp. 1825–1833, DOI : 10.1056 / NEJMoa021328 , PMID 12466506 .
- ^ Carlsson J și colab. , Studiu randomizat de control al ratei versus control al ritmului în fibrilația atrială persistentă: studiul Strategii de tratament al fibrilației atriale (STAF) , în J Am Coll Cardiol , n. 41, 2003, pp. paginile 1690-1696, DOI : 10.1016 / S0735-1097 (03) 00332-2 , PMID 12767648 .
- ^ Hohnloser SH, Kuck KH și Lilienthal J, Controlul ritmului sau al ratei în fibrilația atrială - Intervenție farmacologică în fibrilația atrială (PIAF): un studiu randomizat , în Lancet , nr. 356, 2000, pp. 1789–1794, DOI : 10.1016 / S0140-6736 (00) 03230-X , PMID 11117910 .
- ^ Ablația cateterului versus terapia antiaritmică cu medicamente pentru procesul de fibrilație atrială (CABANA) , pe cabanatrial.org . Adus la 17 august 2015 (arhivat din original la 5 septembrie 2015) .
- ^ Kirchhof P și colab. , Parametrii de rezultat pentru studiile de fibrilație atrială: rezumat executiv. Recomandări de la o conferință de consens organizată de competența germană de fibrilare atrială (AFNET) și Asociația Europeană a Ritmului Cardiac (EHRA) , în Eur Heart J , n. 28, 2007, pp. 2803-2817, DOI : 10.1093 / eurheartj / ehm358 , PMID 17897924 .
- ^ Stewart S și colab. , Prevalența populației, incidența și predictorii fibrilației atriale în studiul Renfrew / Paisley , în Heart , n. 86, 2001, pp. 516-521, DOI : 10.1136 / heart.86.5.516 , PMID 11602543 .
- ^ (EN) Heeringa, și colab., Prevalența, incidența și riscul de fibrilație atrială pe viață: Studiul de la Rotterdam [ link rupt ] ( rezumat ), în European Heart Journal , n. 27, martie 2006, pp. 949-953. Adus pe 9 ianuarie 2009 .
- ^ Lloyd-Jones DM și colab. ,Risc pe viață pentru dezvoltarea fibrilației atriale: studiul Framingham Heart , în circulație , n. 110, 2004, pp. 1042-1046, DOI : 10.1161 / 01.CIR.0000140263.20897.42 , PMID 15313941 .
- ^ Heeringa J și colab. ,Prevalența, incidența și riscul de fibrilație atrială pe viață: studiul de la Rotterdam , în Eur Heart J , n. 27, 2006, pp. 949–953, DOI : 10.1161 / 01.CIR.0000140263.20897.42 , PMID 15313941 .
- ^ Benjamin EJ și colab. , Factori de risc independenți pentru brilierea atrială într-o cohortă bazată pe populație: Framingham Heart Study , în JAMA , vol. 271, 1994, pp. 840–4, DOI : 10.1001 / jama . 1994.03510350050036 , PMID 8114238 .
- ^ Nieuwlaat R și colab. , Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on Atrial Fibrillation , in Eur Heart J , vol. 26, 2005, pp. 2422–2434, DOI : 10.1093/eurheartj/ehi505 , PMID 16204266 .
- ^ Gersh BJ et al. , 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of CardiologyFoundation/AmericanHeartAssociationTaskForce on Practice Guidelines , in J Am Coll Cardiol , n. 58, 2011, pp. e212–60, DOI : 10.1016/j.jtcvs.2011.10.020 , PMID 22093723 .
- ^ Cappola AR et al. , Thyroid status, cardiovascular risk, and mortality in older adults , in JAMA , n. 295, 2006, pp. 1033–41, DOI : 10.1001/jama.295.9.1033 , PMID 16507804 .
- ^ Frost L et al. , Overweight and obesity as risk factors for atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study , in Am J Med 2005 , n. 118, pp. 489–95, DOI : 10.1016/j.amjmed.2005.01.031 , PMID 15866251 .
- ^ AS. Gami et al. , Obstructive sleep apnea, obesity, and the risk of incident atrial fibrillation. , in J Am Coll Cardiol , vol. 49, n. 5, febbraio 2007, pp. 565-71, DOI : 10.1016/j.jacc.2006.08.060 , PMID 17276180 .
- ^ S. Kodama et al. , Alcohol consumption and risk of atrial fibrillation: a meta-analysis. , in J Am Coll Cardiol , vol. 57, n. 4, gennaio 2011, pp. 427-36, DOI : 10.1016/j.jacc.2010.08.641 , PMID 21251583 .
- ^ JP. Mathew et al. , A multicenter risk index for atrial fibrillation after cardiac surgery. , in JAMA , vol. 291, n. 14, aprile 2004, pp. 1720-9, DOI : 10.1001/jama.291.14.1720 , PMID 15082699 .
- ^ LD. Hillis et al. , 2011 ACCF/AHA Guideline for Coronary Artery Bypass Graft Surgery. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Developed in collaboration with the American Association for Thoracic Surgery, Society of Cardiovascular Anesthesiologists, and Society of Thoracic Surgeons. , in J Am Coll Cardiol , vol. 58, n. 24, dicembre 2011, pp. e123-210, DOI : 10.1016/j.jacc.2011.08.009 , PMID 22070836 .
- ^ J. Heeringa et al. , Cigarette smoking and risk of atrial fibrillation: the Rotterdam Study. , in Am Heart J , vol. 156, n. 6, dicembre 2008, pp. 1163-9, DOI : 10.1016/j.ahj.2008.08.003 , PMID 19033014 .
- ^ A. Aizer et al. , Relation of vigorous exercise to risk of atrial fibrillation. , in Am J Cardiol , vol. 103, n. 11, giugno 2009, pp. 1572-7, DOI : 10.1016/j.amjcard.2009.01.374 , PMID 19463518 .
- ^ L. Mont et al. , Long-lasting sport practice and lone atrial fibrillation. , in Eur Heart J , vol. 23, n. 6, marzo 2002, pp. 477-82, DOI : 10.1053/euhj.2001.2802 , PMID 11863350 .
- ^ WB. Kannel et al. , Prevalence, incidence, prognosis, and predisposing conditions for atrial fibrillation: population-based estimates. , in Am J Cardiol , vol. 82, 8A, ottobre 1998, pp. 2N-9N, PMID 9809895 .
- ^ a b RJ. Aviles et al. ,Inflammation as a risk factor for atrial fibrillation. , in Circulation , vol. 108, n. 24, dicembre 2003, pp. 3006-10, DOI : 10.1161/01.CIR.0000103131.70301.4F , PMID 14623805 .
- ^ KK. Patton et al. , N-terminal pro-B-type natriuretic peptide is a major predictor of the development of atrial fibrillation: the Cardiovascular Health Study. , in Circulation , vol. 120, n. 18, novembre 2009, pp. 1768-74, DOI : 10.1161/CIRCULATIONAHA.109.873265 , PMID 19841297 .
- ^ A.Raviele, Linee guida AIAC per la gestione e il trattamento della fibrillazione atriale. Aggiornamento 2013 ( PDF ), su aiac.it . URL consultato il 23 ottobre 2015 .
- ^ A. Frustaci et al. , Histological substrate of atrial biopsies in patients with lone atrial fibrillation. , in Circulation , vol. 96, n. 4, agosto 1997, pp. 1180-4, PMID 9286947 .
- ^ P. Kirchhof et al. , Outcome parameters for trials in atrial fibrillation: recommendations from a consensus conference organized by the German Atrial Fibrillation Competence NETwork and the European Heart Rhythm Association. , in Europace , vol. 9, n. 11, novembre 2007, pp. 1006-23, DOI : 10.1093/europace/eum191 , PMID 17897925 .
- ^ M. Haïssaguerre et al. , Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. , in N Engl J Med , vol. 339, n. 10, settembre 1998, pp. 659-66, DOI : 10.1056/NEJM199809033391003 , PMID 9725923 .
- ^ TH. Everett, JE. Olgin, Atrial fibrosis and the mechanisms of atrial fibrillation. , in Heart Rhythm , vol. 4, 3 Suppl, marzo 2007, pp. S24-7, DOI : 10.1016/j.hrthm.2006.12.040 , PMID 17336879 .
- ^ KT. Konings et al. , High-density mapping of electrically induced atrial fibrillation in humans. , in Circulation , vol. 89, n. 4, aprile 1994, pp. 1665-80, PMID 8149534 .
- ^ SM. Narayan et al. , Treatment of atrial fibrillation by the ablation of localized sources: CONFIRM (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation) trial. , in J Am Coll Cardiol , vol. 60, n. 7, agosto 2012, pp. 628-36, DOI : 10.1016/j.jacc.2012.05.022 , PMID 22818076 .
- ^ ( EN ) AM. Kim et al. , Role of atrial substrate and spatiotemporal organization in atrial fibrillation. , in Heart Rhythm , vol. 6, 8 Suppl, agosto 2009, pp. S1-7, DOI : 10.1016/j.hrthm.2009.02.010 , PMID 19631905 .
- ^ P. Kirchhof et al. , Early and comprehensive management of atrial fibrillation: executive summary of the proceedings from the 2nd AFNET-EHRA consensus conference 'research perspectives in AF'. , in Eur Heart J , vol. 30, n. 24, dicembre 2009, pp. 2969-77c, DOI : 10.1093/eurheartj/ehp235 , PMID 19535417 .
- ^ DM. Hodgson-Zingman et al. , Atrial natriuretic peptide frameshift mutation in familial atrial fibrillation. , in N Engl J Med , vol. 359, n. 2, luglio 2008, pp. 158-65, DOI : 10.1056/NEJMoa0706300 , PMID 18614783 .
- ^ DF. Gudbjartsson et al. , A sequence variant in ZFHX3 on 16q22 associates with atrial fibrillation and ischemic stroke. , in Nat Genet , vol. 41, n. 8, agosto 2009, pp. 876-8, DOI : 10.1038/ng.417 , PMID 19597491 .
- ^ MC. Wijffels et al. , Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats. , in Circulation , vol. 92, n. 7, ottobre 1995, pp. 1954-68, PMID 7671380 .
- ^ CA. Morillo et al. , Chronic rapid atrial pacing. Structural, functional, and electrophysiological characteristics of a new model of sustained atrial fibrillation. , in Circulation , vol. 91, n. 5, marzo 1995, pp. 1588-95, PMID 7867201 .
- ^ S. Neef, LS. Maier, Novel aspects of excitation-contraction coupling in heart failure. , in Basic Res Cardiol , vol. 108, n. 4, luglio 2013, p. 360, DOI : 10.1007/s00395-013-0360-2 , PMID 23740218 .
- ^ SM. Chaldoupi et al. , The role of connexin40 in atrial fibrillation. , in Cardiovasc Res , vol. 84, n. 1, ottobre 2009, pp. 15-23, DOI : 10.1093/cvr/cvp203 , PMID 19535379 .
- ^ B. Burstein, S. Nattel, Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation. , in J Am Coll Cardiol , vol. 51, n. 8, febbraio 2008, pp. 802-9, DOI : 10.1016/j.jacc.2007.09.064 , PMID 18294563 .
- ^ D. Rahmutula et al. , Molecular basis of selective atrial fibrosis due to overexpression of transforming growth factor-β1. , in Cardiovasc Res , vol. 99, n. 4, settembre 2013, pp. 769-79, DOI : 10.1093/cvr/cvt074 , PMID 23612580 .
- ^ SN. Reilly et al. , Atrial sources of reactive oxygen species vary with the duration and substrate of atrial fibrillation: implications for the antiarrhythmic effect of statins. , in Circulation , vol. 124, n. 10, settembre 2011, pp. 1107-17, DOI : 10.1161/CIRCULATIONAHA.111.029223 , PMID 21844076 .
- ^ JY. Youn et al. , Oxidative stress in atrial fibrillation: an emerging role of NADPH oxidase. , in J Mol Cell Cardiol , vol. 62, settembre 2013, pp. 72-9, DOI : 10.1016/j.yjmcc.2013.04.019 , PMID 23643589 .
- ^ J. Kornej et al. , The emerging role of biomarkers in atrial fibrillation. , in Can J Cardiol , vol. 29, n. 10, ottobre 2013, pp. 1181-93, DOI : 10.1016/j.cjca.2013.04.016 , PMID 23962731 .
- ^ ( EN ) [ Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC) ], Guidelines for the management of atrial fibrillation , in European Heart Journal , n. 31, 2010, pp. 2369-2429, DOI : 10.1093/eurheartj/ehq278 .
- ^ Eugene Braunwald, Peter Libby, Robert O. Bonow, Douglas P. Zipes, Douglas L. Mann, Braunwald's Heart Disease. A textbook of cardiovascular medicine , 8ª ed., Saunders Elsevier, 2008, ISBN 978-1-4160-4105-4 .
- ^ AR. Kansal, M. Sharma; C. Bradley-Kennedy; A. Clemens; BU. Monz; S. Peng; N. Roskell; SV. Sorensen, Dabigatran versus rivaroxaban for the prevention of stroke and systemic embolism in atrial fibrillation in Canada. Comparative efficacy and cost-effectiveness. , in Thromb Haemost , vol. 108, n. 4, settembre 2012, pp. 672-82, DOI : 10.1160/TH12-06-0388 , PMID 22898892 .
- ^ S. Deitelzweig, A. Amin; Y. Jing; D. Makenbaeva; D. Wiederkehr; J. Lin; J. Graham, Medical cost reductions associated with the usage of novel oral anticoagulants vs warfarin among atrial fibrillation patients, based on the RE-LY, ROCKET-AF, and ARISTOTLE trials. , in J Med Econ , vol. 15, n. 4, 2012, pp. 776-85, DOI : 10.3111/13696998.2012.680555 , PMID 22449118 .
- ^ J. Steffel, E. Braunwald, Novel oral anticoagulants: focus on stroke prevention and treatment of venous thrombo-embolism. , in Eur Heart J , vol. 32, n. 16, agosto 2011, pp. 1968-76, 1976a, DOI : 10.1093/eurheartj/ehr052 , PMID 21421599 .
- ^ BRINAVESS (vernakalant) for Infusion Approved in the European Union for Rapid Conversion of Recent Onset Atrial Fibrillation , su merck.com , Merck & Co., Inc., 1º settembre 2010. URL consultato il 28 settembre 2010 (archiviato dall' url originale il 28 settembre 2010) .
Bibliografia
- Rowlands DJ, Interpretazione dell'elettrocardiogramma , Pro.Med. Editore, 2004, ISBN 978-88-6521-011-6 .
- Zipes, Libby & Bonow Mann, Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine , 10th Edition, Saunders, 2014, ISBN 978-1-4557-5133-4 .
- Issa, Miller & Zipes, Clinical Arrhythmology and Electrophysiology: A Companion to Braunwald's Heart Disease, Expert Consult - Online and Print , 2nd Edition, Saunders, 2012, ISBN 978-1-4557-1274-8 .
- Mark E. Josephson, Josephson's Clinical Cardiac Electrophysiology , 5 ed, Lippincott Williams&Wilki, 2015, ISBN 978-1-4511-8741-0 .
- Laurence Brunton e Randa Hilal Dandan, Goodman & Gilman's. The pharmacological basis of therapy , McGraw-Hill Education, 2011, ISBN 978-0-07-162442-8 .
Voci correlate
- Ablazione della fibrillazione atriale
- Aritmia
- Cardioversione
- Classificazione di Lown
- Fenomeno di Ashman
- Flutter atriale
- Nuovi anticoagulanti orali
- Sistema di conduzione del cuore
- Tecnologia AFIB
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su fibrillazione atriale
Wikimedia Commons contiene immagini o altri file su fibrillazione atriale
Collegamenti esterni
- ( EN ) Fibrillazione atriale , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
- Associazione Italiana di Aritmologia e Cardiostimolazione(AIAC) , su aiac.it .
- Heart Rhythm Society , su hrsonline.org .
| Controllo di autorità | Thesaurus BNCF 23217 · LCCN ( EN ) sh85009546 · GND ( DE ) 4278966-7 · BNF ( FR ) cb122616614 (data) · NDL ( EN , JA ) 01103770 |
|---|